
【题目】已知:体积为VmL质量分数为a%的硫酸,密度为ρg·mL-1,摩尔质量为Mg·mol-1,物质的量浓度为cmol·L-1,则下列关系式正确的是
A. ![]() B.
B. ![]() C. M=ρ·V·a% D.
C. M=ρ·V·a% D. ![]()
科目:高中化学 来源: 题型:
【题目】下图中的每一个方格表示有关的一种反应物或生成物,其中X为正盐,A、C、D均为无色气体,且气体C的水溶液显碱性。

(1)用化学用语按要求填空:
X的化学式为:__________,X中含有化学键类型为__________;A的电子式__________。
(2)写出反应②的离子方程式___________________________。
(3)过量的Fe粉与G的稀溶液反应,向反应后溶液中加入碱溶液,现象是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂就可以鉴别:①Ba(NO3)2;②AgNO3;③NaCl;④CuCl2,则鉴别出的先后顺序为( )
A. ①③②④ B. ③②④① C. ②③①④ D. ④②③①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某一元弱酸HA的相对分子质量为M。在t℃时,将a g HA完全溶解于水中,得V mL饱和溶液,测得该溶液的密度为ρ g/cm3,其中n(A)为b mol。下列叙述中,错误的是
A.溶液中:c(H+)=[1000b+c(OH)V]/V mol/L
B.t℃时,HA的溶解度:S=(100a/ρ)V g
C.物质的量浓度:c(HA)=(1000a/MV) mol/L
D.HA的质量分数:ω(HA)=(a/ρV)×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2015·新课标全国卷Ⅰ]NA为阿伏加德罗常数的值。下列说法正确的是
A.18 gD2O和18 gH2O中含有的质子数均为10NA
B.2 L 0.5 mol·L1亚硫酸溶液中含有的H+离子数为2NA
C.过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D.密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布。下图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成。下列说法正确的是
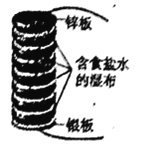
A. 该原电池正极的电极方程式为:O2+4e-+4H+==2H2O
B. 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O
C. 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g
D. 该伏打电堆工作时,在银板附近会有Cl2放出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe、HCN与K2CO3在一定条件下发生如下反应:
Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)此化学方程式中涉及的第二周期元素的电负性由小到大的顺序为___________________。
(2)配合物K4Fe(CN)6的中心离子是____________,该离子价电子的基态电子排布图为____________。
(3)lmol HCN分子中含有σ键的数目为____________,HCN分子中碳原子轨道杂化类型是____________,与CN-互为等电子体的阴离子是____________。
(4)K2CO3中阴离子的空间构型为____________,其中碳原子的价层电子对数为____________。
(5)冰的晶体结构模型如图,它的晶胞与金刚石相似,水分子之间以氢键相连接,在一个晶胞有__________个氢键,若氢键键长为d nm,则晶体密度(g/cm3)计算式为____________(用NA表示阿伏伽德罗常数的值)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com