
 .
.分析 (1)找出不同类的物质,要抓住其余5种物质的共同点,可以从物理性质和化学性质两方面进行分析;
(2)氧化还原反应中存在元素化合价的变化,根据物质的性质结合氧化还原反应和非氧化还原反应的特征来书写方程式;
(3)根据常见物质的转化关系分析,氧化还原反应与离子反应不存在包含关系,但二者有交集;
(4)食醋属于溶液,淀粉溶液属于胶体,根据胶体的特点,可用丁达尔效应鉴别.
解答 解:(1)①根据氧元素的化合价来分类,在CO2、CaO、MgO、Fe2O3、Na2O中氧元素的化合价是-2价,但是Na2O2中元元素是-1价,故答案为:Na2O2;根据物质的类别或是化合物中氧元素的化合价;
②根据化合物CaO、MgO、Fe2O3、Na2O2、Na2O在常温下的状态均为固态,只有CO2是气态,
故答案为:CO2;根据物质在常温下的状态;
(2)Na2O2与水反应的离子方程式是:2Na2O2+2H2O=4Na++4OH-+O2↑,在氧化还原反应中存在元素化合价的变化,在给定的物质中,碱性氧化物氧化钙和酸性氧化物二氧化硅的反SiO2+CaO=CaSiO3应属于非氧化还原反应,过氧化钠具有氧化性,可以和二氧化硫反应生成硫酸钠,即2Na2O2+2CO2=2Na2CO3+O2,
故答案为:CaO+CO2=CaCO3;2Na2O2+2CO2=2Na2CO3+O2;
(3)离子反应有的是氧化还原反应,有的不是氧化还原反应,二者的关系可以用右图表示,
A代表氧化还原反应,B代表离子反应,其中的C代表即是氧化还原反应又是离子反应的化学反应,故答案为 :
:
;
(4)生活中的食醋属于溶液,淀粉溶液属于胶体,鉴别二者的方法是丁达尔现象,故答案为:溶液;胶体;丁达尔现象.
点评 该题考查了物质的分类以及氧化还原反应的特征方面的知识,该考点的基础性比较强,主要出现在选择题和填空题中


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液、胶体、浊液属于不同的分散系 | |
| B. | 胶体与其他分散系的本质区别是胶体分散质粒子直径在1nm-100nm之间 | |
| C. | 可利用丁达尔现象鉴别溶液和胶体 | |
| D. | 利用过滤的方法可以分离胶体和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中无法确定Al3+的存在 | |
| B. | 原溶液中不含的离子为:K+、Cu2+、CO32- | |
| C. | 步骤②中可以确定存在Cl-、Fe2+、NO3- | |
| D. | 步骤③中共有2种钡盐沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
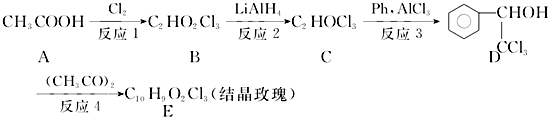
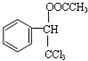 .
.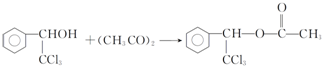 .
.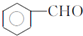 ,F与氯仿合成D的反应方程式为
,F与氯仿合成D的反应方程式为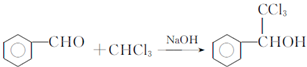 .已知2分子F在KCN存在下可通过授受H反应生成安息香
.已知2分子F在KCN存在下可通过授受H反应生成安息香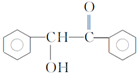 ,请写出上述反应方程式
,请写出上述反应方程式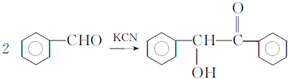 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
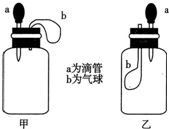 如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )
如图所示,挤压胶头滴管(装有液体)a,将液体加入到广口瓶(装有另一种物质)中,两装置中的气球(干瘪)b都有明显地胀大(忽略液体体积对气球的影响,以及外界和广口瓶间热量的传递影响).则所用试剂不可能是( )| A. | 甲:H2O和CaO(固体);乙:H2O和NH4NO3(固体) | |
| B. | 甲:盐酸和Na2O2(固体);乙:亚硫酸钠溶液和氯气 | |
| C. | 甲:NaOH溶液和CO2;乙:盐酸和NaHCO3溶液 | |
| D. | 甲:浓H2SO4和蔗糖(固体);乙:H2O和NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCH5+与1molNH2-所含电子数均为10NA | |
| B. | 60gSiO2晶体中所含[SiO4]四面体数为0.5NA | |
| C. | 25℃,pH=10的Na2CO3溶液中所含OH-数为1×10-4NA | |
| D. | 标准状况下,22.4LCO、NO混合气体中所含氧原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铁螺丝连接锌板时,铁不容易生锈 | |
| B. | 反应CaC03(s)=Ca0(s)+C02(g)在常温下不能发生,则该反应的△H<0 | |
| C. | pH=11的NaOH溶液与pH=3的CH3COOH溶液混合后所得溶液pH小于7 | |
| D. | 电解精炼铜时,每转移1mol电子阳极上溶解的铜原子数小于0.5×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com