

| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
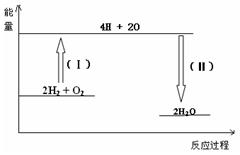
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®2H+(aq) + (aq)+ (aq)+ (aq)+2OH (aq)+2OH (aq)=BaSO4(s)+2H (aq)=BaSO4(s)+2H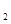 O(l); O(l); H= H= 57.3 kJ/mol 57.3 kJ/mol |
B£®KOH(aq)+ H H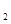 SO4(aq)= SO4(aq)=  K K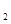 SO4(aq)+H SO4(aq)+H O(l); O(l); H= H= 57.3kJ/mol 57.3kJ/mol |
C£®C8H18(l)+  O O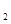 (g)=8CO (g)=8CO (g)+ 9H (g)+ 9H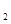 O; O; H= H= 5518 kJ/mol 5518 kJ/mol |
D£®2C8H18(g)+25O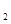 (g)=16CO (g)=16CO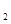 (g)+18H (g)+18H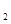 O(l); O(l); H= H= 5518 kJ/mol 5518 kJ/mol |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®µ±?H©0Ź±£¬±ķŹ¾øĆ·“Ó¦ĪŖĪüČČ·“Ó¦ |
B£®ĻąĶ¬Ģõ¼žĻĀ£¬ČÜŅŗÖŠ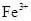 ”¢ ”¢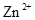 ”¢ ”¢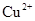 µÄŃõ»ÆŠŌŅĄ“Ī¼õČõ µÄŃõ»ÆŠŌŅĄ“Ī¼õČõ |
| C£®Ē¦Šīµē³ŲŌŚ·Åµē¹ż³ĢÖŠ£¬øŗ¼«ÖŹĮæ¼õŠ”£¬Õż¼«ÖŹĮæŌö¼Ó |
| D£®øÖĢśĪüŃõøÆŹ“µÄÕż¼«µē¼«·“Ó¦£ŗO2£«2H2O£«4e£==4OH£ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
 £ØŹÆÄ«£© £½
£ØŹÆÄ«£© £½  £Ø½šøÕŹÆ£©£¬ŌŚøĆ·“Ó¦½ų³ĢÖŠĘäÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ÓŠ¹ŲøĆ·“Ó¦µÄĆčŹöÕżČ·µÄŹĒ£Ø £©
£Ø½šøÕŹÆ£©£¬ŌŚøĆ·“Ó¦½ų³ĢÖŠĘäÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ÓŠ¹ŲøĆ·“Ó¦µÄĆčŹöÕżČ·µÄŹĒ£Ø £©
| A£®øĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦ |
| B£®½šøÕŹÆ±ČŹÆÄ«ĪČ¶Ø |
| C£®øĆ·“Ó¦ĪŖŃõ»Æ»¹Ō·“Ó¦ |
| D£®ŹÆÄ«±Č½šøÕŹÆĪČ¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ĪļÖŹ·¢Éś»Æѧ·“Ó¦¶¼°éĖę×ÅÄÜĮæ±ä»Æ”£ |
| B£®°éÓŠÄÜĮæ±ä»ÆµÄĪļÖŹ±ä»Æ¶¼ŹĒ»Æѧ±ä»Æ”£ |
| C£®ŌŚŅ»øöČ·¶ØµÄ»Æѧ·“Ó¦¹ŲĻµÖŠ£¬·“Ó¦ĪļµÄ×ÜÄÜĮæÓėÉś²śĪļµÄ×ÜÄÜĮæÓŠæÉÄÜĻąĶ¬”£ |
| D£®Čē¹ū¾É»Æѧ¼ü¶ĻĮŃĪüŹÕµÄÄÜĮæ“óÓŚŠĀ»Æѧ¼üŠĪ³ÉŹĶ·ÅµÄÄÜĮ棬ŌņøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦”£ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®Ć¾ÓėŃĪĖį·“Ó¦·Å³öĒāĘų | B£®ĒāŃõ»ÆÄĘÓėŃĪĖįµÄ·“Ó¦ |
| C£®ĮņŌŚæÕĘųÖŠČ¼ÉÕ | D£®Ba(OH)2?8H2OÓėNH4Cl·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ŠæÓėĻ”ŃĪĖį·“Ó¦ | B£®×ĘČȵÄľĢæÓėCO2·“Ó¦ |
| C£®CaCO3øßĪĀ·Ö½ā | D£®ĀČ»Æļ§ÓėĻūŹÆ»Ņ·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®1:3.4 | B£®1:1.7 | C£®2.6:1 | D£®4.6:1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com