
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为测定其组成,进行如下实验。
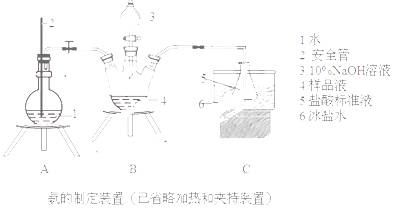
①氨的测定:精确称取wgX,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1mLc1 mol·L—1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L—1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。
②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是 。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用 式滴定管,可使用的指示剂为 。
(3)样品中氨的质量分数表达式为 。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将 (填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是 ;滴定终点时,若溶液中c(Ag+)=2.0×10—5 mol·L—1,c(CrO42—)为 mol·L—1。(已知:Ksp(Ag2CrO4)=1.12×10—12)
(6)经测定,样品X中钴、氨和氯的物质的量之比为1:6:3,钴的化合价为 ,制备X的化学方程式为 ;X的制备过程中温度不能过高的原因是 。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
人类活动对自然界中氮循环和环境的影响。
(1)氮氧化物是形成________和________的一个重要原因。
(2)光化学烟雾是指______________________________________________________。
(3)大气中氮氧化物主要来源于____________________________________________。
(4)氮的水体污染:进入水体的氮的含量增大,会导致藻类“疯长”,迅速地覆盖在水面上,造成水体的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五瓶无色溶液,它们分别是HCl溶液、NaCl溶液、CaCl2溶液、AgNO3溶液和Na2CO3溶液中的一种。把它们两两混合,发生如下反应:
①A+B―→白色沉淀;②A+C―→白色沉淀;
③B+C―→白色沉淀;④C+E―→白色沉淀;
⑤C+D―→白色沉淀;⑥E+A―→无色气体。
(1)由此推断:A是__________溶液;B是__________溶液;C是__________溶液;D是__________溶液;E是__________溶液。
(2)写出①③⑥中所对应的离子方程式:
①___________________________________________________;
③___________________________________________________;
⑥___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法中不正确的是( )
A.正丁烷和异丁烷的熔、沸点不相同
B.乙烯、苯、乙酸分子中的所有原子都在同一平面上
C.C4H9Br的同分异构体有4种
D.乙烯和甲烷可用酸性高锰酸钾溶液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
过氧化钠保存不当容易变质,生成Na2CO3。
(1)某过氧化钠样品已经部分变质,请你选择一种溶液 ,证明过氧化钠已经变质。
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用下图装置来测定过氧化钠的质量分数。
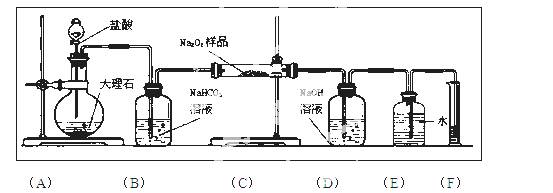
上图中的E和F构成量气装置,用来测定O2的体积。
①写出装置B中发生反应的离子方程式:
②NaOH的作用是
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为
查看答案和解析>>
科目:高中化学 来源: 题型:
化学实验有助于理解化学知识,形成化学观念,提高探究与创新能力,提升科学素养。
(1)在实验室中用浓盐酸与MnO2共热制取Cl2并进行相关实验。
①下列收集Cl2的正确装置是 。
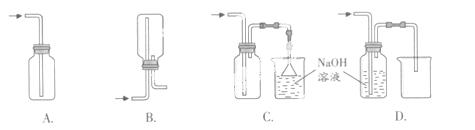
②将Cl2通入水中,所得溶液中具有氧化性的含氯粒子是 。
③设计实验比较Cl2和Br2的氧化性,操作与现象是:取少量新制氯水和CCl4于试管中,
。
(2)能量之间可以相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。
限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见图15),并作相应标注。
要求:在同一烧杯中,电极与溶液含相同的金属元素。
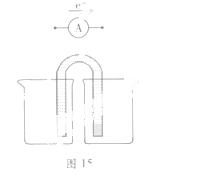
②铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极 。
③甲乙两种原电池中可更有效地将化学能转化为电能的是 ,其原因是 。
(3)根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在(2)的材料中应选
作阳极。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,有沉淀产生且不会消失的是( )
|
| A. | 向NaOH溶液中逐滴滴入Fe2(SO4)3溶液直至过量 |
|
| B. | 将NaOH溶液逐滴滴入AlCl3溶液中,直至过量 |
|
| C. | 向AlCl3溶液中逐滴滴入稀硫酸 |
|
| D. | 将氨水逐滴滴入硝酸银溶液中,直至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将磷肥生产中形成的副产物石膏(CaSO4•2H2O)转化为硫酸钾肥料和氯化钙水合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
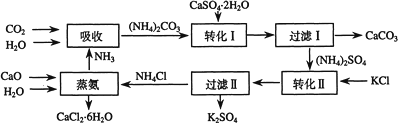
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要 等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有 (填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32﹣的方法是: .
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体 g
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是
A、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液里存在重要的酸碱平衡: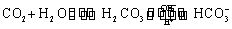 使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随
使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。其pH随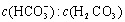 变化关系如下表:
变化关系如下表:
|
| 1.0 | 17.8 | 20.0 | 22.4 |
| pH | 6.10 | 7.35 | 7.4 | 7.45 |
下列说法不正确的是( )
A.正常人体血液中,HCO3-的水解程度大于电离程度
B.人体血液酸中毒时,可注射NaHCO3溶液缓解
C.pH=7.00的血液中,c(H2CO3)<c(HCO3-)
D.pH=7.40的血液中,HCO3-的水解程度一定大于H2CO3的电离程度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com