
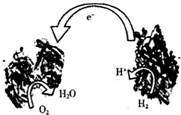
 2006年,科学家发明了一种能够给电子设备提供动力的生物燃料电池.该电池的两个涂覆着催化剂酶的电极处于充满空气和少量氢气的玻璃槽中,总反应为:2H2+O2?2H2O,由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图.下列说法不正确的是( )
2006年,科学家发明了一种能够给电子设备提供动力的生物燃料电池.该电池的两个涂覆着催化剂酶的电极处于充满空气和少量氢气的玻璃槽中,总反应为:2H2+O2?2H2O,由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图.下列说法不正确的是( )| A、右边电极为该电池的负极 | B、该电池可以在高温环境下使用 | C、该装置为化学能转变为电能的装置 | D、该电池正极发生的是还原反应 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
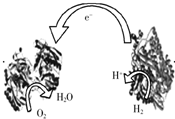 (2008?梅州一模)2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示.下列说法正确的是( )
(2008?梅州一模)2006年,科学家们发明了一种能够给电子设备提供动力的生物燃料电池.该电池包括两个涂覆着酶的电极,它们处于充满空气和少量氢气的玻璃槽中.由于气体可以混合从而省去了昂贵的燃料隔离膜,其工作原理如图所示.下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
| T/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.50 | 2.42 |
查看答案和解析>>
科目:高中化学 来源: 题型:
①能使酸性KMnO4溶液褪色 ②能发生加聚反应生成高分子化合物 ③有4种同分异构体 ④能与氢气发生加成反应
A.①②③ B.②③④ C.①③④ D.①②④
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省枣庄市高三4月模拟考试(理综)化学部分 题型:填空题
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)常温下,某氨水的pH=12,则水电离的c(OH-)= 。若向该氨水中加入等体积、等物质的量浓度的盐酸,此时溶液中水电离的程度 (填“大于”、“等于”或“小于”)氨水中水的电离程度。
(2)合成氨反应N2(g)+3H2(g) 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡
移动(填“向左”、“向右”或“不”)。
(3)一定温度下,在密闭容器中可发生下列反应:2N2O5(g) 4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
4NO2(g)+O2(g)。下表为反应在T1温度下的部分实验数据:
|
T/s |
0 |
500 |
1000 |
|
c(N2O5)/mol·L-1 |
⑤.00 |
3.50 |
2.42 |
则500s内N2O5的分解速度v(N2O5)=
;降温至T2,反应进行1000s时测得c(NO2)=4.98mol·L-1,则反应N2O5(g) NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
NO2(g)+O2(g)的△H 0。(填“>”、“=”、“<”)。
(4)最近美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:
4NH3+3O2
2N2+6H2O。你认为电解质溶液应显 (填“酸性”、“中性”或“碱性”),写出正极的电极反应方程式
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com