
①K2[Zn(OH)4] ②Na3[Co(NO2)6] ③[PtCl2(NH3)2] ④[Co(NH3)6]Cl3
科目:高中化学 来源: 题型:
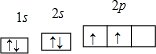


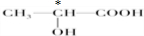
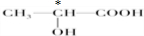
查看答案和解析>>
科目:高中化学 来源: 题型:
[Co(NH3)6]Cl3 [Co(NH3)5(H2O)]Cl3 [Pt(NH3)4]Cl [Pt(NH3)2Cl2]Cs2 [CoCl4]·CsCl (注意:配位数和配位体的区别)
查看答案和解析>>
科目:高中化学 来源:同步题 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)K2Cu(CN)2 (2)K2Na[Co(ONO)6] (3)[Cr(SCN)4(NH3)2]-
_______________________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com