
【题目】中学阶段能形成盐的化学反应是十种之多,请写出符合要求的化学方程式。
(1)酸性氧化物+碱![]() 盐+水_____;
盐+水_____;
(2)碱性氧化物+酸![]() 盐+水_____;
盐+水_____;
(3)酸+碱![]() 盐+水____;
盐+水____;
(4)酸![]() 盐____。
盐____。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验。

已知:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是_________。
(2)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入水至形成一段液柱,若_________,则整个装置气密性良好。装置E作用是_________。
(3)实验结束后,取B中溶液适量于试管中,加热,可观察到的现象是__________。
(4)实验过程中,装置C中的溶液变浑浊。实验结束后,将装置C中的物质_________(填实验操作名称)、干燥,得到白色粉末。取少量粉末于试管中,加入适量稀盐酸,振荡,粉末不溶解,则装置C中生成的沉淀是_____________(填名称)。
(5)实验过程中,装置D中的溶液褪色,并产生黑色沉淀(经检测是MnO2),则装置D中发生反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置(部分夹持装置略去)进行相应的实验,能达到实验目的的是
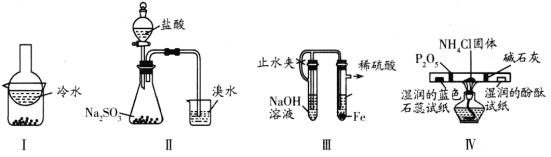
A. 加热装置Ⅰ中的烧杯分离I2和高锰酸钾固体
B. 用装置Ⅱ验证二氧化硫的漂白性
C. 用装置Ⅲ制备氢氧化亚铁沉淀
D. 用装置Ⅳ检验氯化铵受热分解生成的两种气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为___________(用a、b 表示)。
(2)负极反应式为________。
(3)电极表面镀铂粉的原因为___________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是_____,反应Ⅱ中的氧化剂是_____。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为________。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池总反应的离子方程式为:2Fe3++Fe![]() 3Fe2+,能实现该反应的原电池是
3Fe2+,能实现该反应的原电池是
A. 正极为Cu,负极为Fe,电解质为FeCl3溶液
B. 正极为C,负极为Fe,电解质为FeSO4溶液
C. 正极为Fe,负极为Zn,电解质为Fe2(SO4)3溶液
D. 正极为Ag,负极为Cu,电解质为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+3B(g)=2C(g)+D(g),经2min,B的浓度减少0.6 molL-1。对此反应速率的表示正确的是( )
①用A表示的反应速率是0.4 molL-1min-1
②分别用B、C、D表示的反应速率其比值为3:2:1
③在2 min末的反应速率,用B表示是0.3 molL-1min-1
④在这2 min内用B表示的反应速率的值是逐渐减小的,用C表示的反应速率的值是逐渐增大的
A. ①②
B. ③
C. ①
D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2常用于催化剂。某化学小组在实验室选用下图所示装置 (夹持装置略)采用镁屑与液溴为原料制备无水MgBr2。

已知:①在浓硫酸存在下,加热到140℃时乙醇脱水生成乙醚(C2H5OC2H5),加热到170℃时乙醇脱水生成CH2 = CH2。
②乙醚的熔点为34.6℃,沸点为132℃。
③Mg和Br2剧烈反应,放出大量的热;MgBr2具有强吸水性;MgBr2能与乙醚发生反应 MgBr2 +3C2H5OC2H5 ![]() MgBr2 3C2H5OC2H5。
MgBr2 3C2H5OC2H5。
实验主要步骤如下:
I.选用上述部分装置,正确连接,检查装置的气密性。向装置中加入药品。
II.加热装置A,迅速升温至140℃,并保持140℃加热一段时间,停止加热。
III.通入干燥的氮气,让液溴缓慢进入装置B中,直至完全加入。
IV.装置B中反应完毕后恢复至室温,过滤反应物,将得到的滤液转移至干燥的烧瓶中,在冰水中冷却,析出晶体,再过滤得三乙醚合溴化镁粗产品。
V.用苯洗涤粗产品,减压过滤,得三乙醚合溴化镁,将其加热至160℃分解得无水 MgBr2。
回答下列问题:
(1)装置A中使用仪器m的优点是________。
(2)步骤I中所选装置的正确连接顺序是a________ (填小写字母)。装置D的作用是________。
(3)若加热装置A一段时间后发现忘记加入碎瓷片,应该采取的正确操作是________。
(4)步骤V中用苯洗涤三乙醚合溴化镁的目的是________。
(5)步骤V采用减压过滤(使容器内压强降低,以达到固液快速分离)。下列装置可用作减压过滤的是________(填序号)。

(6)实验中若温度控制不当,装置B中会产生CH2Br—CH2Br。请设计实验验证 CH2Br—CH2Br的存在:从反应后的混合物中分离提纯得到CH2Br—CH2Br,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)2Z(g),有关下列图像的说法正确的是

A. 依据图甲可判断正反应为放热反应
B. 在图乙中,虚线可表示升高温度
C. 若正反应的ΔH<0,图丙可表示降低温度使平衡向逆反应方向移动
D. 由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂生产的漂白粉,产品说明书如下:
漂白粉使用说明书
主要成分:次氯酸钙、氯化钙
用法用量:每次取漂白粉2 g,水1 000 mL,配成0.2%~0.3%的浊液。
将病人用具浸泡其中5~10分钟,如需要,浓度可提高,时间可延长。
注意事项:……
回答下列问题:
(1)请你为漂白粉写一份保存、使用的注意事项(不超过35字)_____。
(2)用化学方程式表示:
①漂白粉的生产原理:______________;
②一般情况下,漂白粉失效的主要原因:__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com