
【题目】室温下向10mL、0.1mol/L的NaOH溶液中加入0.1mol/L的HA溶液,溶液pH的变化曲线如图所示。下列说法正确的是( )
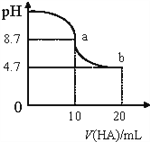
A. pH=7时,c(Na+)= c(A-)+c(HA)
B. a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
C. b点所示溶液中:c(A-)>c(HA)
D. a、b两点所示溶液中水的电离程度相同
【答案】C
【解析】A,NaOH溶液中加入HA溶液,溶液中的电荷守恒为c(Na+)+c(H+)=c(A-)+c(OH-),室温pH=7时c(H+)=c(OH-),则c(Na+)=c(A-),A项错误;B,a点加入10mLHA溶液与NaOH溶液恰好完全反应得NaA溶液,a点溶液的pH=8.7,A-发生水解使溶液呈碱性,a点溶液中粒子浓度由大到小的顺序为c(Na+)![]() c(A-)
c(A-)![]() c(HA)
c(HA)![]() c(H+),B项错误;C,b点加入20mLHA溶液与NaOH溶液反应后得到等物质的量浓度的NaA和HA的混合液,b点溶液的pH=4.7说明HA的电离程度大于NaA的水解程度,b点溶液中c(A-)
c(H+),B项错误;C,b点加入20mLHA溶液与NaOH溶液反应后得到等物质的量浓度的NaA和HA的混合液,b点溶液的pH=4.7说明HA的电离程度大于NaA的水解程度,b点溶液中c(A-)![]() c(HA),C项正确;D,a点为NaA溶液,A-的水解促进水的电离,b点为等物质的量浓度的NaA和HA的混合液,HA的电离程度大于NaA的水解程度,HA的电离对水的电离起抑制作用,a点水的电离程度大于b点,D项错误;答案选C。
c(HA),C项正确;D,a点为NaA溶液,A-的水解促进水的电离,b点为等物质的量浓度的NaA和HA的混合液,HA的电离程度大于NaA的水解程度,HA的电离对水的电离起抑制作用,a点水的电离程度大于b点,D项错误;答案选C。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】一种生活中常用的纯碱溶液浓度为 0.5 mol/L,某同学欲用纯碱粉末配制该溶液 480 mL 备用。请回答下列相关问题:
(1)除烧杯、玻璃棒外,一定还需要用到的玻璃仪器有____________
(2)计算:需要称取纯碱固体的质量为__________ g
(3)配制时,正确的操作顺序是(每个序号只用一次)_______________
A.用少量水洗涤烧杯 2 次~3 次,洗涤液均注入容量瓶,振荡
B.在盛有纯碱固体的烧杯中加入适量水溶解
C.将恢复到室温的溶液沿玻璃棒注入容量瓶中
D.将容量瓶塞紧,上下颠倒摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相平
F.继续往容量瓶内小心加水,直到液面接近刻度 1 cm~2 cm 处
(4)下列会导致所配溶液实际浓度偏高的是____________
a.在 C 步骤中未恢复到室温即注入容量瓶
b.在 D 步骤完成后发现液面低于刻度线
c.在 E 步骤中俯视凹液面
(5)若欲用上述溶液另外配制 100 mL 0.2 mol/L 的纯碱溶液,则需取用上述溶液的体积为_________mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于强、弱电解质的叙述中正确的是( )
A. 强电解质都是离子化合物,弱电解质都是共价化合物
B. 强电解质都是可溶性化合物,弱电解质都是难溶性化合物
C. 强电解质熔化时都完全电离,弱电解质在水溶液中部分电离
D. 强电解质不一定能导电,弱电解质溶液的导电能力不一定比强电解质弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O) 是一种强还原剂,沸点118.5℃,熔点-40℃,常温下为无色透明的油状液体,属于二元弱碱,在空气中可吸收CO2而产生烟雾。水合肼的制备装置如图。
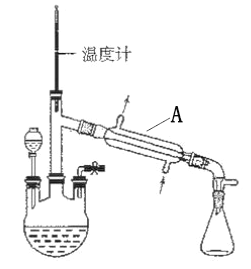
(1)装置A的名称为________________。向三颈烧瓶中加入溶液之前,应先从右侧导管中通入氮气,目的是______________________。
(2)水合肼可用含NaOH 的NaClO溶液氧化尿素[CO(NH2)2]溶液制得,反应的化学方程式为__________________。
(3)制备水合肼时,分液漏斗应盛装________(填标号)。理由是___________。
a.NaOH 和NaClO 混合溶液 b.CO(NH2)2 溶液
(4)弱酸性条件下水合肼可处理电镀废水,将Cr2O72-还原为Cr(OH)3沉淀而除去,水合肼被氧化为N2,该反应的离子方程式为_____________。常温下Ksp[Cr(OH)3]= 10-32,且当溶液中离子浓度小于10-5mol/L时可视作沉淀完全。则Cr3+沉淀完全时,溶液的pH=________。
(5)有同学认为该实验收集装置有缺陷。请你写出改进措施:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中的杂质(括号中是杂质)分别可以用什么试剂和方法除去。
物质 | 试剂 | 方法 |
①乙醇(水) | ___ | ___ |
②乙酸乙酯(乙酸) | ___ | ___ |
③甲烷(乙烯) | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是___________。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
② | 在FeCl2溶液中加入锌片 |
| Zn+Fe2+=Zn2++Fe | |
③ | 在FeCl3溶液中加入足量铁粉 |
| Fe+2Fe3+=3 Fe2+ | Fe3+具有氧化性 |
④ |
|
| Fe3+具有氧化性 |
实验结论:_________________________________。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有:_____。(填序号)
A、Cl2 B、Na C、Na+ D、Cl- E、SO2 F、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属冶炼的说法正确的是
A.由于铝的金属性强,故工业上采用电解熔融AlCl3的方法生产单质铝
B.将钠投入氯化镁饱和溶液中,可置换出镁单质
C.根据金属的活泼性不同,采用不同的金属冶炼方法
D.铝热反应需要在高温下进行,是一个典型的吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物P是某抗病毒药物的中间体,它的一种合成路线如下。
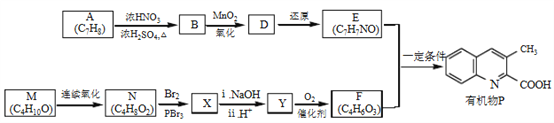
已知:

(1)A为芳香化合物,其结构简式是________________________________________
(2)A→B的化学方程式是,_____________________反应类型是_____________________________________
(3)M无支链,N中含有的官能团是_________________________________
(4)M连续氧化的步骤如下:
![]()
M转化为Q的化学方程式是________________________________。
(5)X的分子式是C4H7O2Br。下列说法正确的是(_______)
a.F能发生酯化反应和消去反应
b.Y在一定条件下可生成高分子化合物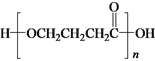
c.1 molX与NaOH溶液反应时,最多消耗2mol NaOH
(6)E的结构简式是_____________________________________
(7)以乙烯为起始原料,选用必要的无机试剂合成M,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com