
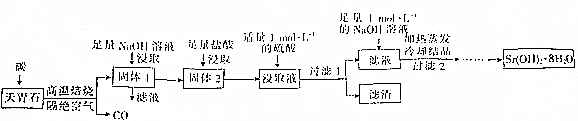
分析 以天青石(主要成分为SrSO4含有BaCO3、SiO2)为原料制备八水合氢氧化锶[Sr(OH)2•8H2O],由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,加NaOH溶解SiO2,过滤后剩余固体中主要含有SrS,加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,再加入足量NaOH溶液,最后蒸发、冷却结晶得到Sr(OH)2•8H2O;
(1)研磨粉碎可以增加反应物的接触面积,提高反应速率,提高原料的转化率;
(2)焙烧过程中发生的主反应为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑,另外还有C与氧气的反应、C与SiO2等的副反应发生,均为氧化还原反应;焙烧过程中碳为还原剂,氧化产物为CO,每个碳由0价升高为+2价;
(3)用HCl溶解SrS后的溶液中含有杂质钡离子,加入硫酸的后生成硫酸钡沉淀从而除去溶液中Ba2+杂质;
(4)根据钡离子浓度、硫酸钡的溶度积计算出钡离子完全除去时硫酸根离子的浓度,然后根据硫酸锶的溶度积计算出需要锶离子的最小浓度;
(5)过滤1后的滤液中含有氯化锶,加入过量氢氧化钠溶液后,生成了氢氧化锶,再蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得Sr(OH)2•8H2O;
(6)称取2.80g该产品(含少量无机盐杂质)于坩埚中,加热至恒重,称得剩余固体质量为1.18g,质量的减轻为2.80g-1.18g=1.62g,根据Sr(OH)2•8H2O分解反应计算样品中Sr(OH)2•8H2O的质量并计算纯度.
解答 解:以天青石(主要成分为SrSO4含有BaCO3、SiO2)为原料制备八水合氢氧化锶[Sr(OH)2•8H2O],由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,加NaOH溶解SiO2,过滤后剩余固体中主要含有SrS,加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,再加入足量NaOH溶液,最后蒸发、冷却结晶得到Sr(OH)2•8H2O;
(1)天青石焙烧前为了增加反应物的接触面积,提高化学反应速率,从而提高原料的转化率可以先研磨粉碎,故答案为:研磨粉碎;
(2)焙烧过程中发生的主反应为SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑,另外还有2C+O2$\frac{\underline{\;加热\;}}{\;}$2CO、2C+Si$\frac{\underline{\;加热\;}}{\;}$Si+2CO,均为氧化还原反应;焙烧过程中碳为还原剂,氧化产物为CO,当有5mol碳被氧化共转移10mol电子,故答案为:2C+O2$\frac{\underline{\;加热\;}}{\;}$2CO或2C+Si$\frac{\underline{\;加热\;}}{\;}$Si+2CO;10NA;
(3)用盐酸溶解后的浸取液里含有Ba2+,滴加稀硫酸,有BaSO4沉淀生成,过滤后得到滤渣为BaSO4,故答案为:BaSO4;
(4)由于在Ba2+浓度为1×10-5 mol/L,BaSO4的溶度积常数为1.1×10-10,所以c(SO42-)=$\frac{1.1×1{0}^{-10}}{1×1{0}^{-5}}$mol/L=1.1×10-5$\frac{3.3×1{0}^{-7}}{1.1×1{0}^{-5}}$mol/L,而SrSO4的溶度积常数为3.3×10-7,所以c(Sr2+)=mol/L=3.0×10-2=0.03mol/L,
故答案为:0.03;
(5)将溶液蒸发浓缩、冷却结晶,然后从溶液中将晶体过滤出来,洗涤除去表面的杂质离子并进行干燥即获得Sr(OH)2•8H2O,
故答案为:洗涤、干燥;
(6)设固体中含有Sr(OH)2•8H2O质量为mg,
Sr(OH)2•8H2O$\frac{\underline{\;加热\;}}{\;}$SrO+9H2O
266 162
mg 1.62g
m=2.66g,产品的纯度为$\frac{2.66g}{2.80g}×100%$=95%,
故答案为:95%.
点评 本题考查制备实验方案的设计,为高频考点,把握制备流程中发生的化学反应及物质分离方法为解答的关键,涉及反应速率、氧化还原反应、滴定原理等,注意信息与所学知识的综合应用,综合性较强,题目难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
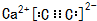 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸馏装置中,温度计水银球的位置在蒸馏烧瓶的支管口处. | |
| B. | “苯甲酸的重结晶”实验步骤是:加热溶解---趁热过滤---冷却结晶---滤出晶体 | |
| C. | 在萃取实验中,溶质在萃取剂中的溶解度小于在原溶剂中的溶解度 | |
| D. | 在过滤实验中,应做到“一贴,二低,三靠” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
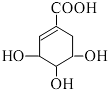
| A. | 分子式为 C7H6O5 | |
| B. | 分子中含有 2 种官能团 | |
| C. | 可发生加成和水解反应 | |
| D. | 该有机物能发生消去反应和催化氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
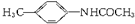 是制备甲氯芬那酸的中间产物,该中间产物是利用下面的反应制得:
是制备甲氯芬那酸的中间产物,该中间产物是利用下面的反应制得: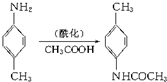 则该反应的反应类型为( )
则该反应的反应类型为( )| A. | 酯化反应 | B. | 加成反应 | C. | 消去反应 | D. | 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
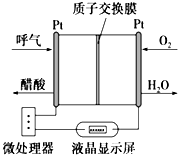 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.其中电极均为Pt电极.下列说法不正确的是( )| A. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| B. | O2在右侧电极发生还原反应,且该电极附近溶液的pH升高 | |
| C. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
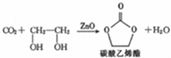
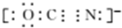 ,Y-的结构式为
,Y-的结构式为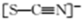 ,Z-的化学式为HF2-.
,Z-的化学式为HF2-.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44gCO2和N2O的混合物中含有的氧原子数为1.5NA | |
| B. | 2L0.5mol/L亚硫酸氢钠溶液中含有的HSO3-离子数为NA | |
| C. | 氢氧化钠与氯气反应时,生成0.1molNaCl转移的电子数为0.1NA | |
| D. | 一定条件下在密闭容器中2molSO2与2molO2充分反应,最终的气体分子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
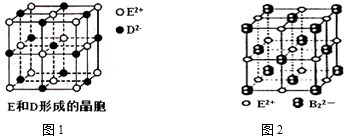
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1817 | 2745 | 11578 |
| B | 738 | 1451 | 7733 | 10540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com