
| A. | 砖块中的主要成分是硅酸盐 | |
| B. | 青砖中的铁元素主要以氢氧化亚铁的形式存在 | |
| C. | 红砖中的铁元素主要以氧化铁的形式存在 | |
| D. | 青砖中的铁元素主要以氧化亚铁的形式存在 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
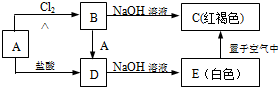
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
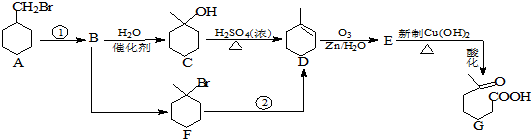
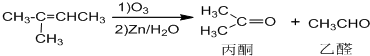
 +NaOH+2Cu(OH)2$\stackrel{加热}{→}$
+NaOH+2Cu(OH)2$\stackrel{加热}{→}$ +Cu2O↓+3H2O.
+Cu2O↓+3H2O.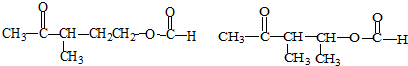
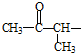 ②属于酯类 ③能发生银镜反应
②属于酯类 ③能发生银镜反应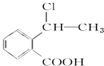 为原料制备
为原料制备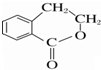 的合成路线流程图(无机试剂任用),并注明反应条件.
的合成路线流程图(无机试剂任用),并注明反应条件.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
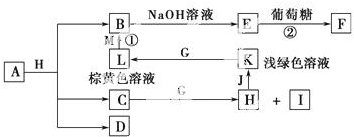
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 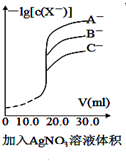 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图可确定首先沉淀的是C- | |
| B. | 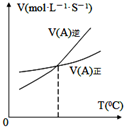 图表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应 | |
| C. | 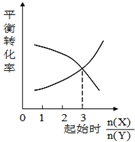 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3Y?Z | |
| D. | 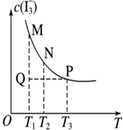 图表示溶液中反应:I2+I-?I3- 平衡c(I3-)随温度变化,反应速度V(正)M<V(逆)N |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| … | W | ||
| X | Y | … | Z |
| A. | 离子半径:X>Y>Z>W | |
| B. | 气态氢化物的稳定性W>Z | |
| C. | 元素X与Z形成的化合物中只含有离子键 | |
| D. | 最高价氧化物对应水化物的碱性X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
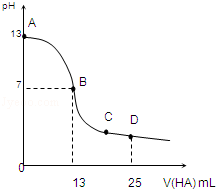 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com