
【题目】溴化镁(MgBr2)可由金属镁在室温下与干燥后的溴在乙醚中反应制得,利用如图所示装置制备溴化镁,并测定其产率。已知:
①Mg和Br2反应剧烈且放热,MgBr,2具有强吸水性;
②MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5.
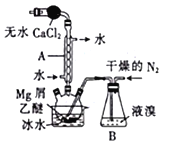
(1)保存液溴时在瓶内加入适量的蒸馏水,其目的是___________。
(2)球形干燥管中放入无水CaCl2的作用是______________,仪器A的名称是________。
(3)实验时,应缓慢通入干燥的氮气,直至溴完全导入三颈烧瓶中。如果将所用液溴一次性全部加入三颈烧瓶中,其后果是___________________。
(4)反应完毕后恢复至室温过滤,将滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得到三乙醚合溴化镁(MgBr2·3C2H5OC2H5)粗品。第一次过滤得到的固体物质是_______。
(5)常温下用苯溶解粗品,冷却至0℃,析出晶体,经操作a得到三乙醚合溴化镁,加热至160℃分解得到无水MgBr2产品。
①操作a是________________。
②写出三乙醚合溴化镁加热至160℃分解得无水MgBr2的化学方程式:_______________。
(6)反应开始前装入5.0g镁屑和150mL无水乙醚,无水MgBr2在干燥器中冷却到室温后,称量,其质量为29.8g。则该实验制取MgBr2的产率是__________(保留一位小数)。
【答案】 防止液溴挥发 防止空气中的水蒸气进入反应装置 球形冷凝管 反应过于剧烈,使反应过程难以控制 镁屑 过滤、洗涤 MgBr2·3C2H5OC2H5 ![]() MgBr2+3C2H5OC2H5 77.7%
MgBr2+3C2H5OC2H5 77.7%
【解析】(1)液溴易挥发,所以在保存液溴时在瓶内加入适量的蒸馏水,使挥发出来的溴蒸气溶解在蒸馏水中,防止液溴挥发,故答案为:防止液溴挥发。
(2)MgBr2具有强吸水性,所以反应在无水环境下进行,无水CaCl2可以吸水,防止空气中的水分进入;仪器A为球形冷凝管,故答案为:防止空气中的水蒸气进入反应装置;球形冷凝管。
(3)向锥形瓶中通入氮气,瓶中压强增大,将液溴导入反应装置。若将所用液溴一次性全部加入三颈烧瓶中,反应过于剧烈,使反应过程难以控制,所以通入氮气的速率不能过快。故答案为:反应过于剧烈,使反应过程难以控制。
(4)反应完毕后恢复至室温,过滤除去的固体为未反应完的镁屑,故答案为:镁屑。
(5)①再析出晶体之后,经过过滤、洗涤即可得到晶体三乙醚合溴化镁,故答案为:过滤、洗涤。
②三乙醚合溴化镁加热至160℃分解得到无水MgBr2产品,再根据已知信息“MgBr2+3C2H5OC2H5=MgBr2·3C2H5OC2H5”可知MgBr2·3C2H5OC2H5分解的方程式为:MgBr2·3C2H5OC2H5![]() MgBr2+3C2H5OC2H5,故答案为:MgBr2·3C2H5OC2H5
MgBr2+3C2H5OC2H5,故答案为:MgBr2·3C2H5OC2H5![]() MgBr2+3C2H5OC2H5。
MgBr2+3C2H5OC2H5。
(6)根据Mg~MgBr2,理论上生成的m(MgBr2)= ![]() =38.35g,则该实验制取MgBr2的产率为
=38.35g,则该实验制取MgBr2的产率为![]() =77.7%,故答案为77.7%.
=77.7%,故答案为77.7%.


科目:高中化学 来源: 题型:
【题目】右图是一个化学过程的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。
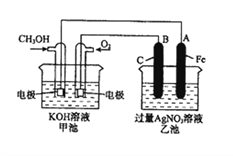
(1)请回答图中甲、乙两池的名称。甲池是________装置,乙池是________装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是__________________,B(石墨)电极的名称是______________________。
(3)写出电极反应式:通入O2的电极的电极反应式是__________________。A(Fe)电极的电极反应式为_______________________________________。
(4)乙池中反应的化学方程式为________________________________________。
(5)当乙池中A(Fe)极的质量增加4.32g时,甲池中理论上消耗O2__________mL(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸镓在激光材料的制备中已成为重要的基础和主要原料。以废催化剂GCS(主要成分为Ga2O3、Cr2O3和SiO2)为原料制备硝酸嫁晶体的工艺流程如下:

(1)滤渣的主要成分是______(写化学式),用稀氨水调节溶液pH至3.0~3.5之间的目的是________。
(2)用硝酸溶解时,温度应控制在40~80℃,实验室控制该温度区间的方法是______;温度高于80℃,溶解速率减慢,其原因是____________。
(3)采用减压蒸馏的目的是_________________。
(4)催化剂GCS可用于催化热乙烯还原一氧化氮,以消除尾气排放对大气的污染,写出该反应的化学方程式:________________。
(5)用硝酸镓制备含镓、铱和铂的催化剂可以有效地催化正庚烷转化为甲苯,该反应的化学方程式为________________。
(6)硝酸镓晶体加热过程中,固体失重率[失重率=![]() ]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。
]随温度的变化关系如图所示。A点时,固体物质的化学式为_________,B点至C点变化过程中,生成的气体为N2O5和另一种氮氧化物,则该变化的总反应方程式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、C、H,它们之间能发生如下图的反应(图中有些反应的产物和反应的条件没有全部标出)。
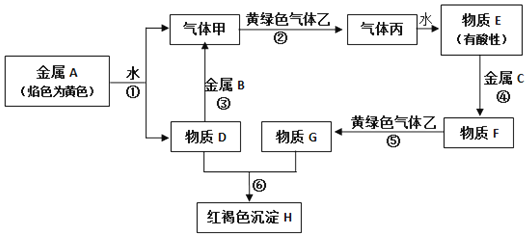
请根据以上信息回答下列问题:
(1)写出下列物质化学式:A_____、B_____、C____、F____、H_____、乙____。
(2)写出下列反应的化学方程式:
反应①______________________________。
反应③________________________________。
反应⑤_________________________________。
(3)物质G中的阳离子如何检验____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是重要的科学研究方法,下列物质分类不正确的是
A. 电解质:明矾、一水合氨、硫酸钡
B. 酸性氧化物: ![]() 、
、![]() 、
、![]() 、
、![]()
C. 混合物:铝热剂、矿泉水、水玻璃、漂白粉
D. 同素异形体: ![]() 、
、![]() 、金刚石
、金刚石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A![]() B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。
B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。
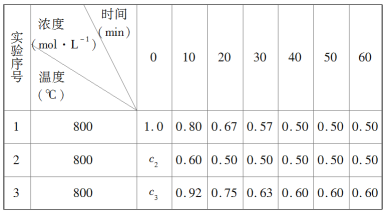
根据上述数据,完成下列填空:
(1)实验1中,10~20 min内A的反应速率为________mol·L-1·min-1。
(2)实验2中,c2=________,反应经20 min时达到平衡,可推测实验2中还隐含的条件是________________________________。
(3)设10~20 min内实验3中A的反应速率为v3,实验1中A的反应速率为v1,则v3________v1(填“>”“=”或“<”),且c3________1.0(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com