
【题目】【山东省日照市2017届高三下学期第二次模拟考试理科综合化学试题】
以含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯Pb、PbO等,实现铅的再生利用。其主要流程如下:

(1)“酸溶”时,在Fe2+催化下,Pb和PbO2反应生成PbSO4,生成1mol PbSO4,转移电子的物质的量是________mol。Fe2+催化过程可表示为:
①2Fe2++PbO2+4H++SO42-=2Fe3++PbSO4+2H2O
②______________________。(用离子方程式表示反应②)
(2)写出脱硫过程发生主要反应的化学方程式:_______________________________。
(3)已知:①PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)==NaHPbO2(aq),其溶解度曲线如右图所示。
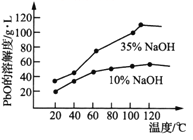
②粗品PbO中所含杂质不溶于NaOH溶液。结合上述信息,完成由粗品PbO得到高纯PbO的操作:将粗品PbO溶解在一定量______(填“35%”或“10%”)的NaOH溶液中,加热至110℃,充分溶解后,_________(填“趁热过滤”或“蒸发浓缩”),将滤液冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。
(4)将PbO粗品溶解在HC1和NaC1的混合溶液中,得到含Na2PbC14的电解液,电解Na2PbC14溶液,生成Pb,如右图所示。
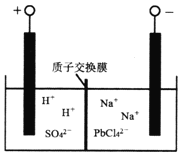
①阴极的电极反应式是__________________________。
②电解一段时间后,Na2PbC14浓度极大下降,为了恢复其浓度且实现物质的循环利用,阴极区采取的方法是________________________。
【答案】 2 2Fe3++Pb+SO42-=PbSO4+2Fe2+ PbSO4+2NaOH![]() PbO+Na2SO4+H2O 35% 趁热过滤 PbCl42-+2e-=Pb+4Cl- 继续向阴极区加PbO粗品
PbO+Na2SO4+H2O 35% 趁热过滤 PbCl42-+2e-=Pb+4Cl- 继续向阴极区加PbO粗品
【解析】以废旧铅酸电池中的含铅废料(Pb、PbO、PbO2、PbSO4及炭黑等)和H2SO4为原料,制备高纯PbO,含铅废料加入硫酸亚铁、稀硫酸加热反应过滤得到PbSO4粗品,加入10%的氢氧化钠溶液加热反应,冷却过滤得到PbO粗品,粗PbO溶解在35%NaOH溶液中配成高温下的饱和溶液,冷却结晶、过滤得PbO。
(1)“酸溶”时,在Fe2+催化下,Pb、PbO2和H2SO4反应生成PbSO4和水,化学方程式为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,根据方程式可知,生成1mol PbSO4,转移2mol电子,故答案为:2;
②催化剂通过参加反应,改变反应历程,降低反应的活化能,加快化学反应速率,而本身的质量和化学性质反应前后保持不变,根据题给信息知反应①中Fe2+被PbO2氧化为Fe3+,则反应ii中Fe3+被Pb还原为Fe2+,离子方程式为:2Fe3++Pb+SO42-═PbSO4+2Fe2+,故答案为:2Fe3++Pb+SO42-═PbSO4+2Fe2+;
(2) 根据上述分析,脱硫过程中发生的反应为PbSO4+2NaOH=PbO+Na2SO4+H2O,故答案为:PbSO4+2NaOH=PbO+Na2SO4+H2O;
(3) ②根据PbO的溶解度曲线,提纯粗Pb的方法为将粗PbO溶解在NaOH溶液中,结合溶解度曲线特点可知浓度高的NaOH溶液和较高的温度,PbO的溶解度高,因此加热至较高温度,充分溶解,然后再高温下趁热过滤除去杂质,后冷却后PbO又析出结晶,再次过滤可得到PbO固体,故答案为:35% ;趁热过滤;
(4)①阴极发生还原反应,Na2PbC14得到电子生成Pb,电极反应式为PbCl42-+2e-=Pb+4Cl-,故答案为:PbCl42-+2e-=Pb+4Cl-;
②阴极发生还原反应,Na2PbC14得到电子生成Pb,电极反应式为PbCl42-+2e-=Pb+4Cl-,阳极发生氧化反应,溶液中的H2O放电生成氧气和氢离子,电极方程式为2H2O-4e--= O2+4H+,电解一段时间后,Na2PbC14浓度极大下降,为了恢复其浓度且实现物质的循环利用,根据少什么加什么,溶液中减少了Pb和O,应该在阴极区加PbO粗品,溶解在HC1和NaC1的混合溶液中,得到含Na2PbC14的电解液,故答案为:继续向阴极区加PbO粗品。


科目:高中化学 来源: 题型:
【题目】将下列物质进行分类(填序号):
①O2与O3②淀粉和纤维素③126C与136C
④  和 CH3CH2CH2CH3⑤
和 CH3CH2CH2CH3⑤ 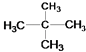 和
和 ![]()
(1)互为同位素的是;
(2)属于糖类的是;
(3)互为同分异构体的是;
(4)属于同系物的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在溶液中大量共存的一组是( )
A.K+、NO3-、HCO3-B.Na+、Ba2+、SO42-
C.Fe2+、Cl-、OH-D.K+、NH4+、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
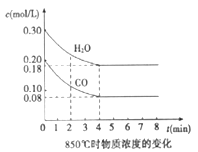
【题目】【江西省景德镇市2017届高三第二次模拟理综化学试题】(1)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);△H<0。CO和H2O浓度变化如图,则04 min的平均反应速率v(CO)=______________ mol/(L·min)
CO2(g)+H2(g);△H<0。CO和H2O浓度变化如图,则04 min的平均反应速率v(CO)=______________ mol/(L·min)
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c4 |
4 | c1 | c2 | c3 | c4 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
请回答:
①表中34 min之间反应处于_____________状态;c3数值_____________0.12 mol/L(填大于、小于或等于)。
②反应在45 min间,平衡向逆方向移动,可能的原因是_____________(单选),表中56 min之间数值发生变化,可能的原因是_____________(单选)。
a.增加了水蒸气的量 b.升高温度 c.使用催化剂 d.增加压强
(3)如图是一个电化学的装置图。
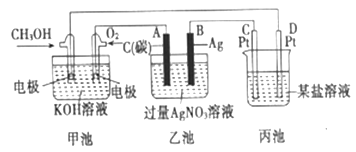
①图中乙池是________装置(填“电解池”或“原电池”)甲池中OH-移向____________极(填“CH3OH”或“O2”)。若丙池中为400ml 1mol/L硫酸铜溶液,当外电路有1mol电子通过时,C、D两极共产生_______mol的气体。
②写出B电极的电极反应式:_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】. A、B、C、D四种短周期元素的原子半径依次减小,A 与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是( )
A. X、Y、Z的稳定性逐渐减弱
B. A、B、C、D只能形成5种单质
C. X、Y、Z三种化合物的熔沸点逐渐降低
D. 自然界存在多种由A、B、C、D四种元素组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定植物光合作用速率最简便的方法是测定单位时间内( )
A.植物体内水的消耗量B.植物体内叶绿体的含量
C.植物体内葡萄糖的消耗量D.植物体消耗的二氧化碳量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com