
【题目】固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许O2-在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )

①多孔电极a为负极
②a极对应的电极反应式为O2+2H2O+4e-==4OH-
③b极的电极反应式为H2-2e-+O2-==H2O
④该电池的总反应式为2H2+O2![]() 2H2O
2H2O
A. ①② B. ②④ C. ②③ D. ③ ④
【答案】D
【解析】①图中电子由多孔电极b通过导线流向多孔电极a,多孔电极b为负极,多孔电极a为正极,①错误;②a极对应的电极反应式为O2+4e-=2O2-,②错误;③b极的电极反应式为H2-2e-+O2-=H2O,③正确;④根据正负极得失电子相等,将正负极电极反应式相加,该电池的总反应式为2H2+O2![]() 2H2O,④正确;正确的是③④,答案选D。
2H2O,④正确;正确的是③④,答案选D。
负极电极反应式 | 正极电极反应式 | |
酸性电解质 | H2-2e-=2H+ | O2+4e-+4H+=2H2O |
碱性电解质 | H2-2e-+2OH-=2H2O | O2+4e-+2H2O=4OH- |
熔融氧化物 | H2-2e-+O2-=H2O | O2+4e-=2O2- |
熔融碳酸盐 | H2-2e-+CO32-=H2O+CO2 | O2+4e-+2CO2=2CO32- |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入2.0 mol X,反应X(g) ![]() Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
Y(g)+Z(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(Y)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法不正确的是
A. 反应在前250 s的平均速率为v(Y)=0.000 8 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(Y)=0.21 mol·L-1,则反应的ΔH>0
C. 相同温度下,起始时向容器中充入4.0 mol Y、4.0 mol Z,达到平衡时,则此反应的化学平衡常数为1/20
D. 相同温度下,若起始时向容器中充入2.0 mol X、0.40 mol Y和0.80 mol Z,则达到平衡前v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 钠和冷水反应:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水与少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
C. 向沸水中滴入适量的饱和氯化铁溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+ OH-=CO32-+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol CH4的质量为________g,约含有______个H,在标准状况下的体积为_______L。
(2)相同质量的CO和CO2,它们所含的原子数之比为_______,在同温同压下,它们的密度之比为______;等物质的量的CO和CO2的混合气体的密度是相同条件下氢气密度的__________倍。
(3)12.4 g Na2R含Na+0.4 mol,则R的相对原子质量为_____________。
(4)已知16 g肼(N2H4)含有的电子数为b,则阿伏加德罗常数为______________。(用含b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL0.1mol/L二元弱酸H2A溶液中滴加0.1mol/LNaOH溶液,溶液中各组分物质的量分数δ(X) [δ(X)=![]() ]随pH的变化如图所示。下列叙述错误的是
]随pH的变化如图所示。下列叙述错误的是
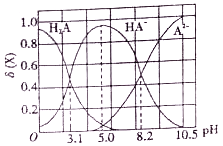
A. Ka1(H2A)为10-3.1
B. pH=5.0时,c(Na+)>c(HA-)>c(H+)>c(OH-)>c(A2-)
C. pH=8.2时,c(Na+)+c(H+)=c(OH-)+3c(A2-)
D. pH由5.0调至10.5时,主要反应的离子方程式为HA-+OH-=A2-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为( )
A. C+H2O===CO+H2 ΔH=+131.3 kJ·mol-1
B. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+10.94 kJ·mol-1
C. C(s)+H2O(l)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
D. C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某废催化剂(含Al2O3 36%、CoS 20%、MoS2 20%、MgO 8%等)为原料生产Co2O3的工艺路线如下:
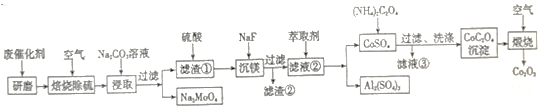
已知: 氧化铝有两种晶型α-Al2O3 和γ- Al2O3,α- Al2O3致密难溶于酸和碱。
(1)废催化剂焙烧前先将其研磨,其目的是_________________________。
(2)已知“焙烧除硫”后的产物有CoO、MoO3。写出Na2CO3溶液“浸取”过程的离子反应方程式:______________________。
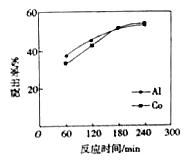
(3) 硫酸浸泡滤渣①的实验条件为硫酸浓度12 mol/L、液固比为3、反应温度60℃。该条件下,铝、钴浸出率与时间关系如图。当浸泡时间小于180 min时,铝、钴浸出率随着时间的推移均增加较快;180 min 后铝和钴的浸出率都提高不多,且钴浸出率高于铝浸出率。试解释180min后钴浸出率高于铝浸出率的原因: ____________________。
(4)萃取剂对Al3+、Co2+萃取率与pH 的关系如图。
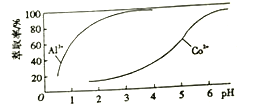
萃取分离钴、铝的实验操作为: 向萃取分液后的有机相中加硫酸调pH=3~4,分液可得CoSO4溶液,___________,可得Al2(SO4)3溶液。
(5)“滤液③”主要物质的化学成分是_______ (写化学式),用途之一为___________________。
(6)“煅烧”过程 相关反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白酒、食醋、蔗糖等均为家庭厨房中常用的物质,利用这些物质能完成下列实验的是
①验证蛋壳能否溶于酸②检验白酒中是否含有甲醇③鉴别食盐和小苏打④检验自来水中是否含有氯离子
A.①②B.②④C.③④D.①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下:
![]() +5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
+5Cu2S+44H+= 10Cu2++5SO2↑+8Mn2++22H2O
![]() +5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
+5CuS+28H+ = 5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式
______![]() +______Fe2++______H+ =______Mn2++______Fe3++______H2O
+______Fe2++______H+ =______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)混合物中Cu2S的质量分数为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com