
【题目】对伞花烃(a)常用作染料、医药、香料的中间体,a可转化为b(如图)。下列说法错误的是( )

A.常温下对伞花烃呈液态且难溶于水
B.b物质的一氯代物有5种
C.对伞花烃分子中最多有9个碳原子共平面
D.图中氢化反应既是加成反应也是还原反应
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是有机合成的重要中间体,制备M的一种合成路线如下(部分反应条件和试剂略去):

已知:①A的密度是相同条件下H2密度的38倍;其分子的核磁共振氢谱中有3组峰;
② (-NH2容易被氧化);
(-NH2容易被氧化);
③ R-CH2COOH
R-CH2COOH
请回答下列问题:
(1)B的化学名称为______。A中官能团的电子式为______。
(2)C![]() D的反应类型是______,I的结构简式为______。
D的反应类型是______,I的结构简式为______。
(3)F![]() G的化学方程式为______。
G的化学方程式为______。
(4)M不可能发生的反应为______(填选项字母)。
a.加成反应 b.氧化反应 c.取代反应 d.消去反应
(5)请写出任意两种满足下列条件的E的同分异构体有______。
①能与FeCl3溶液发生显色反应 ②能与NaHCO3反应 ③含有-NH2
(6)参照上述合成路线,以![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:______。
的合成路线:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池可净化废水,同时还能获得能源或有价值的化学产品,图1为其工作原理,图2为废水中Cr2O72-离子浓度与去除率的关系。下列说法正确的是

A. M为电池正极,CH3COOH被还原
B. 外电路转移4mol电子时,M 极产生22.4LCO2
C. 反应一段时间后,N极附近的溶液pH下降
D. Cr2O72-离子浓度较大时,可能会造成还原菌失活
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二氯丙烷(CH2ClCHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2Cl),反应原理为:
I.CH2=CHCH3(g)+Cl2(g) ![]() CH2ClCHClCH3(g) H1=-134kJ·mol-1
CH2ClCHClCH3(g) H1=-134kJ·mol-1
II.CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g) H2=-102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2Cl(g)+HCl(g) ![]() CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
CH2ClCHClCH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为___________kJ·mol-1。
(2)一定温度下,密闭容器中发生反应I和反应II,达到平衡后增大压强,CH2ClCHClCH3的产率____________(填“增大”“减小”或“不变”),理由是_________________________________。
(3)起始时向某恒容绝热容器中充入1 mol CH2=CHCH3和1 mol Cl2发生反应II,达到平衡时,容器内气体压强_________________(填“增大”“减小”或“不变”)。
(4)某研究小组向密闭容器中充入一定量的CH2=CHCH3和Cl2,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2ClCHClCH3的产率与温度的关系如图所示。p点是否为对应温度下CH2ClCHClCH3的平衡产率,_________填“是”或“否”)判断理由是_______________________。

(5)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和Cl2(g)。在催化剂作用下发生反应I,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]()
②该温度下,若平衡时HCl的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() ____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
____________;反应I的平衡常数Kp=____________________kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaBr、浓硫酸、乙醇等为原料制备少量溴乙烷(反应装置如图所示):C2H5—OH+HBr![]() C2H5—Br+H2O
C2H5—Br+H2O
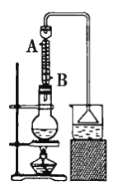
已知物质的用量:0.30molNaBr(s);0.25mol乙醇(密度为0.80g·cm-3);36mL浓硫酸(质量分数为98%,密度为1.84g·mL-1);25mL水。试回答下列问题:
(1)反应装置中烧瓶的容积应选择__(填序号)。
A.50mL B.100mL C.150mL D.250mL
(2)冷凝管中的冷凝水的流向应是__(填序号)。
A.A进B出 B.B进A出 C.从A进或B进均可
(3)实验完成后,需将烧瓶内的有机物蒸出,结果得到棕黄色的粗溴乙烷,欲得纯净的溴乙烷,应采取的操作是___。
(4)某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解反应还是消去反应,则该同学向反应后的溶液中应加入的试剂是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是德国化学家李比希1831年测定烃类化合物(只含C、H两种元素)组成的装置。瓷舟内的烃样品经加热分解或气化后用纯![]() 流驱赶经过灼热的
流驱赶经过灼热的![]() ,这里烃类化合物反应变成
,这里烃类化合物反应变成![]() 和
和![]() ,经吸收管吸收。
,经吸收管吸收。

已知下表数据:
瓷舟 | 吸收管Ⅰ | 吸收管Ⅱ | |||
瓷舟 | 样品+瓷舟 | 吸收前 | 吸收后 | 吸收前 | 吸收后 |
A | B | C | D | E | F |
(1)烃样品在反应过程中所用的氧化剂是________________________;
(2)吸收管Ⅰ应装的吸收剂是____________,吸收管Ⅱ应装的吸收剂是____________;
(3)样品中碳的质量分数的数学表达式是________________________;
(4)取该烃![]() 在氧气中充分燃烧后,生成
在氧气中充分燃烧后,生成![]() 和
和![]() 。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。
。若该烃在一定条件下能与氯气发生取代反应,且其一氯代物只有一种,则烃A的结构简式为___________,用系统命名法命名为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( )
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,插入溶液中的铁棒容易溶解,主要是发生电化学腐蚀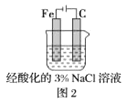
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生电化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的负极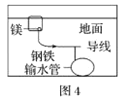
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现艾滋病治疗药物利托那韦对新型冠状病毒也有很好的抑制作用,它的合成中间体2-异丙基-4-(甲基氨基甲基)噻唑可按如下路线合成:

回答下列问题:
(1)A的结构简式是__________,C中官能团的名称为 ______________。
(2)①、⑥的反应类型分别是__________、_____。D的化学名称是______。
(3)E极易水解生成两种酸,写出E与NaOH溶液反应的化学方程式:_______。
(4)H的分子式为 __________________。
(5)I是相对分子质量比有机物 D 大 14 的同系物, 写出I 符合下列条件的所有同分异构体的结构简式:_____________。
①能发生银镜反应 ②与NaOH反应生成两种有机物
(6)设计由 ,和丙烯制备
,和丙烯制备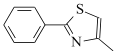 的合成路线______________(无机试剂任选)。
的合成路线______________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com