
分析 (1)根据假设1、2可知,可能由所含铁元素和所含多酚被氧化共同形成;
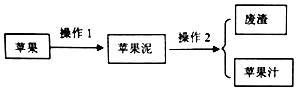
(2)操作1是将固体研碎,需要用到研钵;操作2是将不同的固体与液体分离,应采取过滤操作,过滤后的滤液浑浊需要重复过滤;测定鲜苹果汁的pH为3.48,所用的仪器或用品是pH计;
(3)加入少许某不能与盐酸反应的黑色颗粒,果汁的颜色明显变浅,该黑色物质具有吸附有色物质;
(4)实验(3)中加入少许KSCN溶液,未见红色,苹果汁中没有Fe3+,再加入适量H2O2,仍未见红色,充分加热,液体的颜色反而变为无色,同时有气泡产生,过氧化氢有强氧化性,将有色物质氧化为无色物质,同时过氧化氢不稳定,可以分解生成水与氧气.再滴入少许FeCl2溶液,液体变为红色,Fe2+被过氧化氢氧化为Fe3+,对比说明苹果汁中没有Fe2+;
(5)实验(4)第二份滴加足量溴水,得到白色沉淀,说明苹果汁中含有多酚类物质,上层液体中滴加少许KSCN溶液,也未见红色,说明苹果汁中没有Fe3+,滴入少许CCl4萃取溶液中的溴,证明溴水足量;
(6)实验(5)中第三份加入少许稀HNO3,充分加热,放置一段时间后,液体的颜色逐渐变浅,但仍比加入HNO3前深,再滴加少许KSCN溶液,液体变为红色,溶液中含有Fe3+,说明硝酸可以将苹果中的“Fe”氧化为Fe3+,与(3)中实验相比,过氧化氢不能将苹果中的“Fe”氧化为Fe3+;
加入的少许硝酸先将苹果中的“Fe”氧化为Fe3+,而后Fe3+又氧化多酚等物质,液体的颜色逐渐变浅,结合实验(6)中可知,苹果中Fe与有机物结合在一起,而糖只含有C、H、O三种元素,可以说明营养物质是蛋白质;
(7)第三份加入少许稀HNO3,充分加热,试管中出现红棕色气体,该红棕色气体为二氧化氮,可能是硝酸分解生成二氧化氮,也可能是稀硝酸苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮;
(8)由上述分析可知,苹果汁中没有Fe2、Fe3+,则另取一只苹果,灼烧成灰,加入稀HCl充分搅拌后,取所得液体,滴入KSCN溶液,液体变为红色,说明所得溶液中含有Fe3+,可知苹果中“Fe”与有机物结合在一起.
解答 解:(1)根据假设1、2可知,假设3应为:可能由所含铁元素和所含多酚被氧化共同形成,故答案为:可能由所含铁元素和所含多酚被氧化共同形成;
(2)操作1是将固体研碎,需要用到研钵;操作2是将不同的固体与液体分离,应采取过滤操作,所得苹果汁仍很浑浊,需要重复过滤;测定鲜苹果汁的pH为3.48,所用的仪器或用品是pH计,故答案为:研钵;重复过滤;pH计;
(3)苹果汁呈黄色,加入少许某不能与盐酸反应的黑色颗粒,果汁的颜色明显变浅,该黑色物质具有吸附有色物质,可能为活性炭,故答案为:活性炭;
(4)实验(3)中加入少许KSCN溶液,未见红色,苹果汁中没有Fe3+,再加入适量H2O2,仍未见红色,充分加热,液体的颜色反而变为无色,同时有气泡产生,再滴入少许FeCl2溶液,液体变为红色,Fe2+被过氧化氢氧化为Fe3+,对比说明苹果汁中没有Fe2+,过氧化氢有强氧化性,将有色物质氧化为无色物质,液体的颜色反而变为无色,同时过氧化氢不稳定,可以分解生成水与氧气,体现了H2O2:强氧化性(或漂白性)、不稳定性;故答案为:强氧化性(或漂白性);不稳定性;
(5)实验(4)第二份滴加足量溴水,有少量沉淀生成,静置后,倾出上层液体,固体经洗涤后成白色,说明苹果汁中含有多酚类物质,在倾出的上层液体中滴加少许KSCN溶液,也未见红色,苹果汁中没有Fe3+,再滴入少许CCl4充分振荡后,静置,下层液体呈棕黄色,萃取溶液中的溴,证明加入的溴水是过量的,进一步说明苹果汁中没有Fe3+,故答案为:多酚;证明加入的Br2已经足量;
(6)实验(5)中第三份加入少许稀HNO3,充分加热,放置一段时间后,液体的颜色逐渐变浅,但仍比加入HNO3前深,再滴加少许KSCN溶液,液体变为红色,溶液中含有Fe3+,说明硝酸可以将苹果中的“Fe”氧化为Fe3+,与(3)中实验相比,过氧化氢不能将苹果中的“Fe”氧化为Fe3+,说明硝酸的氧化性强于过氧化氢;
加入的少许硝酸先将苹果中的“Fe”氧化为Fe3+,而后Fe3+又氧化多酚等物质,液体的颜色逐渐变浅,结合实验(6)中可知,苹果中Fe与有机物结合在一起,而糖只含有C、H、O三种元素,可以说明营养物质是蛋白质;故答案为:硝酸的氧化性强于过氧化氢;蛋白质;
(7)第三份加入少许稀HNO3,充分加热,试管中出现红棕色气体,该红棕色气体为二氧化氮,可能是硝酸分解生成二氧化氮,也可能是稀硝酸被苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮,故答案为:硝酸分解生成二氧化氮;稀硝酸被苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮;
(8)由上述分析可知,苹果汁中没有Fe2、Fe3+,则另取一只苹果,灼烧成灰,加入稀HCl充分搅拌后,取所得液体,滴入KSCN溶液,液体变为红色,说明所得溶液中含有Fe3+,可知苹果中“Fe”与有机物结合在一起,故答案为:与有机物结合在一起.
点评 本题考查探究实验、实验方案的评价等,侧重考查学生分析推理能力,是对学生综合能力的考查,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 实验中玻璃棒的作用是加速固体溶解 | |
| B. | 玻璃片上结冰而与小烧杯粘在一起,说明该反应是放热反应 | |
| C. | 反应中断开化学键吸收的总能量低于形成化学键放出的总能量 | |
| D. | 该反应中,反应物的总能量小于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝常温下不与氧气反应 | |
| B. | 铝常温下不与浓硫酸反应产生气体,是因为发生钝化 | |
| C. | 向氯化铝溶液中逐滴加入氨水的现象是先产生白色沉淀,后白色沉淀又溶解 | |
| D. | 氧化铝只能与酸反应,不能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量浓盐酸 | B. | 加入几滴氯化铜溶液 | ||
| C. | 加入适量蒸馏水 | D. | 加入适量的氯化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
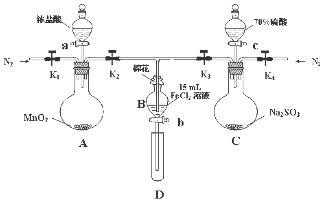 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.
常温下,现有浓度都为0.1mol•L-1HX、HY的溶液各20ml,分别用0.1mol•L-1NaOH溶液滴定.溶液的pH与加入NaOH溶液体积V的关系如图所示.| A. | 滴定过程中,水电离的c(H+)•c(OH-)均不变 | |
| B. | HX的电离程度小于HY的电离程度 | |
| C. | V=10ml时,c(HX)+c(X-)=2c(Na+) | |
| D. | V=20ml时,c(Y-)>c(X-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com