
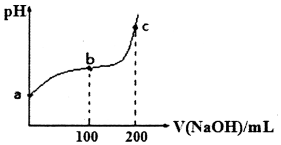
| A. | b~c段,随着NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐增大 | |
| B. | 若a点pH=4,且c(Cl-)=100c(ClO-),则Ka(HClO)=$\frac{1{0}^{-4}}{101}$ | |
| C. | b点对应的溶液可用pH试纸测定其pH | |
| D. | c点对应的溶液中:c(Na+)>c(OH-)>c(C1-)>c(C1O-)>c(H+) |
分析 整个过程先后发生的反应为Cl2+H2O?HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,
A.b~c段,随着NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$=$\frac{c(HClO).c({H}^{+})}{c(Cl{O}^{-}).c({H}^{+})}$=$\frac{c({H}^{+})}{{K}_{(HClO)}}$;
B.若a点pH=4,c(H+)=10-4mol/L,溶液呈酸性,根据氯守恒可知:2c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=4mol/L,且c(Cl-)=100 c(ClO-),GCl完全电离,HClO部分电离且电离程度较小,所以溶液中c(H+)≈c(Cl-)=10-4mol/L,溶液中c(ClO-)=10-6mol/L,c(HClO)=c(Cl-)-c(ClO-)=(10-4mol/L-10-6mol/L)=0.99×10-4mol/L,Ka(HClO)=$\frac{c({H}^{+}).c(Cl{O}^{-})}{c(HClO)}$;
C.b点溶液中溶质为NaCl和NaClO,且物质的量相等,NaClO溶液有漂白性;
D.c点溶液中溶质为NaCl、NaClO、NaOH,且浓度关系为2c(NaCl)=2c(NaClO)=c(NaOH).
解答 解:整个过程先后发生的反应为Cl2+H2O?HCl+HClO、HCl+NaOH═NaCl+H2O、HClO+NaOH═NaClO+H2O,
A.b~c段,随着NaOH溶液的滴入,$\frac{c(HClO)}{c(Cl{O}^{-})}$=$\frac{c(HClO).c({H}^{+})}{c(Cl{O}^{-}).c({H}^{+})}$=$\frac{c({H}^{+})}{{K}_{(HClO)}}$,随着反应的进行,氢离子浓度减小、电离平衡常数不变,所以$\frac{c(HClO)}{c(Cl{O}^{-})}$逐渐减小,故A错误;
B.若a点pH=4,c(H+)=10-4mol/L,溶液呈酸性,根据氯守恒可知:2c(Cl2)+c(Cl-)+c(ClO-)+c(HClO)=4mol/L,且c(Cl-)=100 c(ClO-),GCl完全电离,HClO部分电离且电离程度较小,所以溶液中c(H+)≈c(Cl-)=10-4mol/L,溶液中c(ClO-)=10-6mol/L,c(HClO)=c(Cl-)-c(ClO-)=(10-4mol/L-10-6mol/L)=0.99×10-4mol/L,Ka(HClO)=$\frac{c({H}^{+}).c(Cl{O}^{-})}{c(HClO)}$=$\frac{1{0}^{-4}×1{0}^{-6}}{0.99×1{0}^{-4}}$=$\frac{1{0}^{-4}}{99}$,故B错误;
C.b点溶液中溶质为NaCl和NaClO,且物质的量相等,NaClO溶液有漂白性,所以不能用pH试纸测定其pH值,应该用pH计测定,故C错误;
D.c点溶液中溶质为NaCl、NaClO、NaOH,且浓度关系为2c(NaCl)=2c(NaClO)=c(NaOH),次氯酸根离子水解但程度较小,溶液呈碱性,离子浓度大小顺序是c(Na+)>c(OH-)>c(C1-)>c(C1O-)>c(H+),故D正确;
故选D.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生图象分析判断及计算能力,明确“溶解的氯气不等于发生反应的氯气“是解本题关键,注意B选项的正确计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Al3+的结构示意图: | |
| B. | HC1O的电子式: | |
| C. | 中子数为117、质子数为116的Lv原子:${\;}_{116}^{117}$Lv | |
| D. | HOCH2COOH 缩聚物的结构简式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g乙醛中所含的氧原子数为NA | |
| B. | 足量的铜与40mL10mol/L硝酸反应,生成气体的分子数为0.2NA | |
| C. | 14g乙稀中所含的C-H键数目为2NA | |
| D. | 0.1molNH3中所含的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
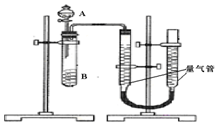 甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.
甲、乙两个实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素.| 序号 | A溶液 | B溶液 |
| ① | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ② | 2mL0.1mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液 |
| ③ | 2mL0.2mol/LH2C2O4溶液 | 4mL0.01mol/LKMnO4溶液和少量MnSO4 |
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
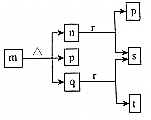 现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )
现有三个不同短周期的X、Y、Z、W同种常见元素,其原子序数依次增大,W为金属元素,其余为非金属元素,它们可形成n、q、r三种常见的二元化合物、p、t两种常见三元化合物、m一种常见的四元化合物,它们之间的转化关系如图所示,其中q为无色透明液体,n为无色无味气体,s可使带火星的木条复燃,其余为固体,下列有关说法正确的是( )| A. | 离子半径:W+>Z2- | |
| B. | Y的非金属性强于Z,故YX4的热稳定性强于q | |
| C. | n和少量t反应生成m,m还可以和t反应生成p和q | |
| D. | 把少量r投入到FeSO4溶液中,产生无色气体和白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己知异丙苯的纺构简式为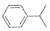 ,则异丙苯中碳原子可能处于同一平面 ,则异丙苯中碳原子可能处于同一平面 | |
| B. | 分子式为C4H9Cl的有机物共有4种同分异构体 | |
| C. | 乙酸和溴乙烷在一定条件下均可发生加成反应 | |
| D. | 油脂和蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4具有氧化性,因此用其制成的波尔多液可用作杀菌剂 | |
| B. | 回收的地沟油可以用来制造肥皂、提取甘油或生产生物柴油 | |
| C. | 绿色化学的核心是应用化学原理从源头上减少和消除工业生产对环境的污染 | |
| D. | 纤雏素属于多糖,但不是人类的营养物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com