
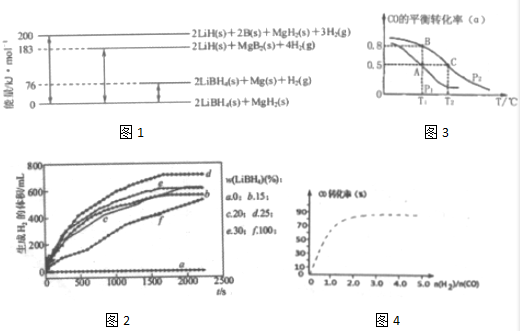
分析 (1)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s),据盖斯定律计算反应的焓变;
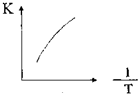
(2)①a.因为由图LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
b.负一价的氢与正一价的氢发生归中反应生成氢气,LiBH4+4H2O=LiB(OH)4+4H2↑;
c.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小;
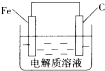
(3)根据温度和CO的转化率确定反应热;温度不变,化学平衡常数不变,温度升高平衡向吸热的方向移动,平衡常数变化;根据CO的转化率求出平衡常数,再根据A、B两点的平衡常数相同求出容器的体积;使用催化剂,加快反应速率,但是不会引起平衡的移动;
(4)根据乙醇和二甲醚中结构简式不同,发生反应时断裂的化学键不同,反应放出的能量不会相同,据此进行判断;
(5)根据磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化及电池放电时负极发生的反应写出电池放电时反应的化学方程式.
解答 解:(1)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
2LiH(s)+MgB2(s)+4H2(g)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+(200-183)kJ•mol-1④
即:MgB2(s)+H2(g)=2B(s)+MgH2(s)△H=+17 kJ•mol-1④
所以-④-②得:Mg(s)+2B(s)═MgB2(s)△H=-(17+76)kJ•mol-1,
故答案为:-93 kJ•mol-1;
(2)①A、25℃时,纯铝与水不反应,因为由图LiBH4含量为0时,氢气的体积为0,故选;
B、25℃时,纯LiBH4与水反应产生氢气,负一价的氢与正一价的氢发生归中反应生成氢气,故选;
C、由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小,故不选;
故答案为:AB;
(3)据图象可知,温度升高平衡逆向移动,即逆反应方向为吸热,所以正反应方向为放热;因B点与A点温度相同,K不变,对于上述反应温度升高平衡向逆反应方向移动,平衡常数减小,所以A、B、C三点的平衡常数KA=KB>KC,T1时,A点对应的α=0.5,据平衡常数表达式可得K=1.因B点与A点温度相同,K不变,
CO(g)+2H2(g)?CH3OH(g).
起始(mol) 10 20 0
转化(mol) 8 16 8
平衡(mol) 2 4 8
则K=$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得:V=2L,使用催化剂,加快反应速率,但是不会引起平衡的移动,当不使用催化剂,起始H2,CO投料比和CO平衡转化率的关系示意图如下: ,故答案为:放热;KA=KB>KC;2;
,故答案为:放热;KA=KB>KC;2; ;
;
(4)化学反应实质是旧键的断裂和新键的生成,放出的能量与旧键断裂吸收的能量和新键的生成放出的能量有关,而二甲醚和乙醇分子中化学键类型不同,所以反应过程中放出的能量不同,所以C正确,
故答案为:C;
(5)磷酸亚铁锂电池充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,其中LiFePO4→Li1-xFePO4的转化化合价降低,发生还原反应,而电池放电时负极发生的反应为:LixC6-xe-═xLi++6C,该反应为氧化反应,所以反应转化应该为:LiFePO4→Li1-xFePO4,所以电池放电时反应的化学方程式为:Li1-xFePO4+LixC6=6C+LiFePO4,
故答案为:Li1-xFePO4+LixC6=6C+LiFePO4.
点评 本题考查了热化学方程式书写、原电池、电解池工作原理、化学反应速率和平衡的影响因素及有关计算等知识,注意把握题中信息,能够正确提取题中信息,联系所学知识进行解答,试题充分培养了学生的分析、理解能力及灵活应用所学知识的能力本题涉及热化学方程式的书写,盖斯定律的应用,电化学知识,综合性非常强,难度大.


科目:高中化学 来源: 题型:选择题
| A. | lH、2H、3H为同素异形体 | B. | lH、2H、3H互为同位素 | ||
| C. | lH、2H、3H的质量数相同 | D. | lH、2H、3H为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液、溴水 | B. | 碳酸钠溶液、溴水 | ||
| C. | KMnO4酸性溶液、溴水 | D. | KMnO4酸性溶液、氯化铁溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
Ⅰ.浓硝酸与浓盐酸混合过程中会产生少量的气体单质X、化合物M和无色液体,化合物M中所有原子均达到8电子的稳定结构.2molM加热分解生成lmol X和2mol无色气体Y,Y遇到空气呈现红棕色.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| B. | 溶液中含大量Al3+:HClO、HCO3-、ClO-、CO32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 中性的溶液中:CO32-、Na+、SO42-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:
铁单质及其化合物在生活、生产中有广泛应用.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
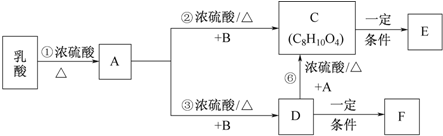
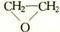 .
. .
.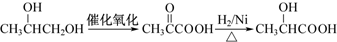 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醇与金属钠的反应 | |
| B. | 苯与浓硝酸、浓硫酸混合共热制取硝基苯 | |
| C. | 在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 | |
| D. | 实验室制乙炔 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com