
【题目】已知25℃时,Ka(HF) = 3.6×10-4 ,Ksp(CaF2) = 1.46×10-10。现向1 L 0.2mol·L-1 HF溶液中加入1 L 0.2 mol·L-1 CaCl2溶液,则下列说法中,正确的是( )
A. 25℃时,0.1 mol·L-1HF 溶液中pH=1 B. 该体系中HF与CaCl2反应产生沉淀
C. Ksp(CaF2)随温度和浓度的变化而变化 D. 加入CaCl2溶液后体系中的c(H+)不变
【答案】B
【解析】
HF为弱酸,0.1 mol·L-1HF溶液中c(H+)= c(F-)=6×10-3 mol·L-1,0.1 mol·L-1HF与0.1 mol·L-1CaCl2反应产生CaF2沉淀,反应的离子方程式为2HF+Ca2+= CaF2↓+2H+。
A、由Ka(HF) = 3.6×10-4 可知HF为弱酸,0.1 mol·L-1HF 溶液中pH>1,故A错误;
B项、混合后溶液中Ca2+浓度为0.1mol·L-1,F-浓度为![]() =6×10-3 mol·L-1,浓度商Q为0.6×10-3>Ksp(CaF2)=1.46×10-10,会与沉淀出现,故B正确;
=6×10-3 mol·L-1,浓度商Q为0.6×10-3>Ksp(CaF2)=1.46×10-10,会与沉淀出现,故B正确;
C项、溶度积只受温度的影响,与浓度无关,故C错误;
D项、0.1 mol·L-1HF与0.1 mol·L-1CaCl2反应产生CaF2沉淀,反应的离子方程式为2HF+Ca2+= CaF2↓+2H+,溶液中c(H+)增大,故D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2为还原产物),其电解的化学方程式为:3H2O+3O2![]() O3+3H2O2。下列有关说法正确的是
O3+3H2O2。下列有关说法正确的是
A. 电解池的阳极生成双氧水,阴极生成臭氧
B. 电解池中H+移向阴极
C. 产生臭氧的电极反应式为3H2O+6e-=O3+6H+
D. 产生双氧水的电极反应式为2H2O-2e- =H2O2+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锶(Sr)为第5周期ⅡA族元素。高纯六水氯化锶晶体(SrCl2.6H2O)具有很高的经济价值,61℃时晶体开始失去结晶水,100℃时失去全部结晶水。用工业碳酸锶粉末(含少量Ba、Fe的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。

请回答:
(1)常温下,氯化锶溶液pH____7(填“大于”、“等于”或“小于”);
(2)步骤③所得滤渣的主要成分是______(填化学式),调节溶液pH至8~10,宜选用的试剂为 ______。
A.稀硫酸 B.氢氧化锶粉末 C.氢氧化钠 D.氧化锶粉末
(3)步骤⑤中,洗涤氯化锶晶体最好选用____。
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是____(填字母)。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+浓度为1×10-6 mol/L,依据下表数据可以推算滤液中Sr2+物质的量浓度为 ________。
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为
A. 1.0 mol/L B. 2.0 mol/L C. 3.0 mol/L D. 4.0 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在图所示的装置中,a的活动性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
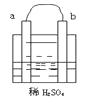
A.碳棒上有气体放出,溶液的pH增大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极流到b极
D.a极上发生了氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1 mol D可与1 mol NaOH或2 mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为_________________。
(4)由E生成F的反应类型为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A. 在铁件上镀铜时,金属铜作阳极
B. 电解精炼粗铜时,电解质CuSO4溶液加少量硫酸是抑制 CuSO4水解
C. 纯锌与稀硫酸反应时,加入少量CuSO4,可使反应速率加快
D. 甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH﹣+6e﹣═CO2+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短同期元素,最高正价依次为+1、+4、+5、+7,其核电荷数按B、C、A、D的顺序增大。已知B、C的次外层电子数为2,D、A的次外层电子数均为8,且A、D原子的电子层数相同。请回答:
(1)写出A、B、C、D的元素符号:A___、B___、C___、D___。
(2)画出A的原子结构示意图:___;
(3)写出AD的电子式:___;
(4)写出A、C的最高价氧化物对应水化物相互反应的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,反应X(g)![]() 4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是
4Y(g)+Z(g) ΔH=-Q kJ·mol-1在2 L恒容密闭容器中进行,X和Z的浓度随时间变化如图所示,下列说法不正确的是

A. 2 min内,X的平均反应速率为0.25 mol·L-1·min-1
B. 第t min时,该反应达到平衡状态
C. 第5 min后,X的生成速率与Z的生成速率相等且保持不变
D. 5 min内,反应放出的热量为1.6Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com