
科目:高中化学 来源: 题型:
NA代表阿伏加德罗常数,下列叙述正确的是
A.1 mol Cl2在反应中得到电子数不一定为2NA
B.1 mol O2在反应中得到电子数一定为4 NA
C.1 mo1 Na2O2与足量H2O反应,转移了2 NA 个电子
D.在2KClO3+4HC1(浓)= =2KCl+2C1O2↑+C12↑+2H2O中,氯气既是氧化产物又是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于皂化反应的说法中,错误的是( )
A.油脂经皂化反应后,生成的高级脂肪酸钠、甘油和水形成混合液
B.加入食盐可以使肥皂析出,这一过程叫盐析
C.加入食盐搅拌后,静置一段时间,溶液分成上下两层,下层是高级脂肪酸钠
D.皂化反应后的混合溶液中加入食盐,可以通过过滤的方法分离提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
有关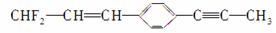 分子结构的下列叙述中正确的是( )
分子结构的下列叙述中正确的是( )
①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上
A.①② B.②③
C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物3.24 g装入元素分析装置,通入足量的氧气使之完全燃烧,将生成的气体依次通过无水CaCl2(A)管和碱石灰(B)管,测得A管增重2.16 g,B管增重9.24 g,已知该有机物的相对分子质量小于200。求该有机物的实验式和化学式。
查看答案和解析>>
科目:高中化学 来源: 题型:
分子式与苯丙氨酸(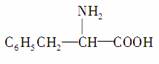 )相
)相
同,且同时符合下列两个条件:①有带两个取代基的苯环;②有一个硝基直接连接在苯环上。那么,这种物质的异构体的数目是( )
A.3种 B.5种
C.6种 D.10种
查看答案和解析>>
科目:高中化学 来源: 题型:
对下列各溶液中,微粒的物质的量浓度关系表述正确的是
A.0.1mol·L-1的(NH4)2CO3溶液中:c(CO32-)>c(NH4+)>c(H+)>c(OH-)
B. 0.1 mol·L-1的NaHCO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-)
C.将0.2 mol·L-1 NaA溶液和0.1 mol·L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-)
D.在25℃时,1mol·L-1的CH3COONa溶液中:c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
①写出CO2与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
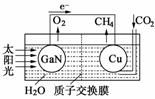
② 科学家用氮化镓材料与铜组装如右图的人工光合系统,
利用该装置成功地实现了以CO2和H2O合成CH4。
写出铜电极表面的电极反应式 。为提高该人工光合系统的工作效率,可向装置中加入少量 (选填“盐酸”或“硫酸”)。
③ 另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)
CH4(g)+H2O(g)。某温度下,将0.1 mol CO和0.3 molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K= 。(计算结果保留两位有效数字)
天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入
空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)  2CO(g)+2H2(g) 。
2CO(g)+2H2(g) 。
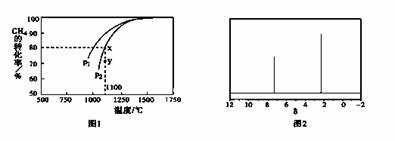
在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”
或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X。由质谱分析得X的相对分子质量为106,其核磁共振氢谱如下图2,则X的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是
①Na2O2中阴、阳离子的个数比是1:1
②Na2O2分别与水及CO2反应产生等量氧气时,需水和CO2的质量相等
③Na2O2分别与水及CO2反应产等量氧气时,转移电子的物质的量相等
④Na2O2的漂白原理与SO2的漂白原理相同
⑤Na2O2与SO2反应生成Na2SO3与H2O
⑥Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
⑦Na2O2与水反应,Na2O2既是氧化剂,又是还原剂
⑧Na2O2投入到紫色石蕊试液中,溶液先变蓝,后褪色
A.①③⑥⑧ B.③⑦⑧ C②⑤⑥⑦ D.①④⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com