
| A. | Ba2Cl2、CuSO4、NaOH、NaCl | B. | Na2SO4、BaCl2、K2CO3、KNO3 | ||
| C. | FeCl3、NaOH、Na2SO4、Ba(NO3)2 | D. | NaCl、Na2CO3、Ca(NO3)2、H2SO4 |
分析 本题要求不用其他试剂,仅用组内物质反应来区分物质,解答本题时就是利用物质的化学特性来解答,具体的可以首先找出有颜色的,然后两两之间反应,或者是找出能其他物质都反应但是现象不同的物质,然后再区别其他物质.
解答 解:A、溶液呈蓝色的为CuSO4溶液,取该溶液滴入另三种溶液,出现白色沉淀的溶液为BaCl2溶液,出现蓝色沉淀的为NaOH溶液,无现象的为NaCl,可以区别该组溶液,故A可选;
B、四种溶液相相互混合,其中有一种溶液加入另三种溶液中时,有两种出现白色沉淀,则该溶液为BaCl2溶液,而无明显现象的溶液为KNO3溶液,其余两种Na2SO4、K2CO3溶液无法进一步进行区分,不能区分该组溶液,故B不可选;
C、溶液为黄色的为FeCl3溶液,取该溶液滴入另三种溶液中,出现红褐色沉淀的溶液为NaOH溶液,另两种溶液无明显现象,不可以区分溶液该组溶液,故C不可选;
D、四种溶液相互混合时,有一种溶液中滴入另三种溶液中,有三种不同现象:生成白色沉淀、有气体产生,无现象,该溶液为Na2CO3溶液,有白色沉淀的为Ca(NO3)2溶液,有气体生成的为H2SO4溶液,无现象的为NaCl,可以区分该组溶液,故D可选;
故选AD.
点评 本题考查了物质性质的分析应用,解答通过组内试验来对物质进行鉴别的题目,首先要根据物质的化学特性来找出一种物质,然后再通过两两之间的反应逐个确认,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | a为H2S,SO2+2H++S2-→3 S↓十2H2O | |
| B. | a为Cl2,Ba2++SO2+2 H2O+Cl2→BaSO3↓+4H++2Cl- | |
| C. | a为NO2,4Ba2++4SO2+5H2O+NO3-→4 BaSO4↓+NH4++6 H+ | |
| D. | a为NH3,Ba2++SO2+2 NH3+2H2O→BaSO4↓+2NH4++2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取用金属钠时,多余的钠应该置于废液槽中,不应放回原试剂瓶中 | |
| B. | 用足量的稀硫酸可以除去Cu粉中混有的Fe2O3杂质 | |
| C. | 在托盘天平上称取2.0g氢氧化钠固体,然后在l00mL容量瓶内溶解并稀释至刻度线,得到0.50 mol/L氢氧化钠溶液 | |
| D. | KMnO4和SO2的反应速率可通过分光光度计用比色法测出不同反应时刻的浓度来计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验目的 | 实验方案 |
| A | 证明其他条件不变时,增大反应物浓度,反应速率加快 | 常温下,对比等量铝粉分别与稀硫酸反应的反应速率 |
| B | 证明SO2具有氧化性 | 将SO2通入酸性KMnO4溶液中,观察溶液是否褪色 |
| C | 证明Ksp(AgCl)>Ksp(Ag2S) | 向2mL0.1mol•L-1AgNO3溶液中加入1mL0.1mol•L-1NaCl溶液,出现白色沉淀,再加入几滴0.1mol•L-1的Na2S溶液,有黑色沉淀生成 |
| D | 证明“84”消毒液(含NaClO)的氧化能力随溶液pH减小而增强 | 将“84”消毒液滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快退去 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
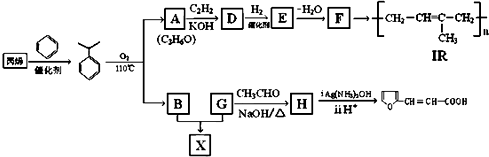
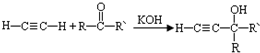
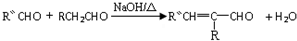 (-R、-R′、-R″表示可能相同或可能不同的原子或原子团)
(-R、-R′、-R″表示可能相同或可能不同的原子或原子团) .
. .
.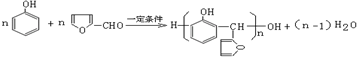 .
.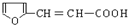 有多种同分异构体,符合下列要求的有9种.
有多种同分异构体,符合下列要求的有9种.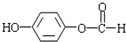 或
或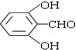 或
或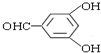 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、Fe2+、NO3- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Na+、OH-、SO42-、H2PO4- | D. | Al3+、Na+、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
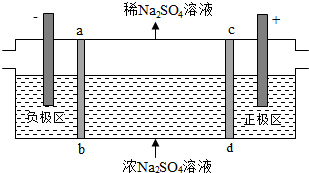
| A. | 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大 | |
| B. | 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 | |
| C. | 负极反应为2H2O-4e-=O2+4H+,负极区溶液pH降低 | |
| D. | 当电路中通过1mol电子的电量时,会有0.5mol的O2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

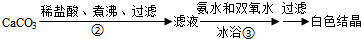
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com