
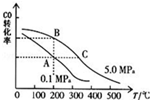
 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题分析 (1)①达到化学平衡时,正逆反应速率相等,各个组分的浓度不随着时间的变化而变化,根据化学平衡的特征,由此衍生出的一系列物理量都不变,据此来判断;
②化学反应的平衡常数随着温度的变化而变化;
③根据化学反应三行式来依据转化率=$\frac{消耗量}{起始量}$×100%和平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$计算;
(2)溶液的酸碱性是根据溶液中H+浓度与OH-浓度的相对大小判断的,只要溶液中c(H+)=c(OH-),溶液就呈中性,HCOOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的甲酸钠是强碱弱酸盐水解呈碱性,需溶液呈中性,需少加碱;当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液显碱性,甲酸根离子水解浓度减小;
(3)正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应;
(4)根据燃烧热的概念以及盖斯定律来计算化学反应的焓变,然后写出热化学方程式.
解答 解:(1)①A.每消耗1molCO的同时生成2molH2,能证明正逆反应速率是相等的,故A错误;
B、该反应是一个前后气体系数和变化的反应,当混合气体总物质的量不变,达到额化学平衡状态,故B错误;
C.生成CH3OH的速率与消耗CO的速率相等,不能证明正逆反应速率是相等的,此时不一定达到化学平衡,故C正确
D.CH3OH、CO、H2的浓度都不再发生变化,是化学平衡状态的特征,故D错误.
故选C;
②根据图中CO的平衡转化率(α)与温度、压强的关系,当温度升该时,一氧化碳的转化率逐渐减小,所以化学平衡向左移动,所以平衡常数减小,又C点温度比B高,所以K(B)>K(C),
故答案为:>;
③将2.0mol CO和6.0mol H2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.25mol/L,则
CO(g)+2H2(g)═CH3OH(g)
初始浓度:1.0 3.0 0
变化浓度:0.75 1.5 0.75
平衡浓度:0.25 1.5 0.75
CO的转化率=$\frac{0.75}{1}$×100%=75%,
此温度下的化学平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$=$\frac{0.75}{0.25×1.{5}^{2}}$≈1.3,
故答案为:75%;1.3;
(2)CH3COOH是弱电解质,电离程度不大,NaOH是强电解质,完全电离,反应生成的甲酸钠是强碱弱酸盐,水解呈碱性,需溶液呈中性pH=7,需少加碱,所以常温下,将V mL、0.20mol•L-1氢氧化钠溶液逐滴加入到20.00mL、0.20mol•L-1甲酸溶液中,充分反应,V<20.00mL溶液呈中性pH=7,c(H+)=c(OH-);当氢氧化钠溶液与甲酸溶液恰好完全反应时,溶液显碱性,甲酸根离子水解浓度减小,溶液中离子浓度大小关系为:c(Na+)>c(HCOO-)>c(OH-)>c(H+);
故答案为:<;c(Na+)>c(HCOO-)>c(OH-)>c(H+);
(3)正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:O2+4e-+2CO2=2CO32-.
(4)由H2(g)的燃烧热△H为-285.8kJ•mol-1知,1molH2(g)完全燃烧生成1molH2O(l)放出热量285.8kJ,
即①H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1;
②CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1,
由盖斯定律可知,3×①-②得CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9 kJ•mol-1,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=-130.9 kJ•mol-1.
点评 本题考查了化学平衡状态的判断、化学平衡移动以及化学平衡常数、离子浓度大小比较、电极方程式的书写等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:多选题
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | B. | BaCl2 Na2SO4 CaCO3 KOH | ||
| C. | AgNO3 NaCl KCl CuCl2 | D. | Fe2(SO4)3 K2CO3 KHSO4 BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石灰石 | B. | 硝酸、烧碱、胆矾 | ||
| C. | 醋酸、碱式碳酸铜、醋酸钠 | D. | 盐酸、熟石灰、苛性钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
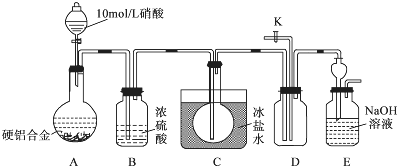
| 金属离子 | 开始沉淀时的pH | 沉淀完全的pH |
| Al3+ | 3.4 | 4.7 |
| Cu2+ | 4.1 | 6.9 |
| Mg2+ | 9.4 | 12.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量水,水的电离平衡向正方向移动 | |
| B. | 加入少量NaHCO3固体,c(ClO-)减小 | |
| C. | 通入少量SO2,溶液漂白性增强 | |
| D. | 加入NaOH固体至溶液呈中性时,c(Na+)═c(Cl-)+c(ClO-)+c(HClO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 | |
| B. | 制氧气时,用Na2O2或H2O2作反应物可选择相同的气体发生装置 | |
| C. | 制乙炔时,用排水法或向上排空气法收集气体 | |
| D. | 制一氧化氮时,用排空气法收集气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]
已知某待测液由Ag+、Fe2+、Al3+、K+、Ba2+、NH4+、NO3-、SO42-中的若干种离子组成,进行如下实验:[已知:含Al3+溶液中加氢氧化钠溶液先生成Al(OH)3沉淀,加氢氧化钠溶液过量沉淀会溶解,反应方程式:Al(OH)3+NaOH=NaAlO2+2H2O]查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com