
| 6-2×3 |
| 2 |
| 6+2-2×4 |
| 2 |


科目:高中化学 来源: 题型:
| A、H2的摩尔质量是2g |
| B、标准状态下,1molH2O 的体积是22.4L |
| C、氧气的摩尔质量是32g/mol |
| D、2gH2含6.02×1023 个H |
查看答案和解析>>
科目:高中化学 来源: 题型:
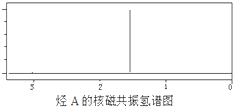 某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:
某烃A经李比希元素分析实验测得碳的质量分数为85.71%,该烃的质谱图显示:分子离子峰的最大质荷比为84,该烃的核磁共振氢谱如图所示.红外光谱表明分子中没有碳碳双键,已知烯烃经臭氧作用发生反应:| ①O3 |
| ②H2O |
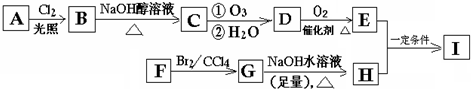
查看答案和解析>>
科目:高中化学 来源: 题型:
3 2 |
3 2 |
4 2 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 实验目的 | 实验操作 |
| A | 测定某溶液的pH | 用玻璃棒蘸取该溶液点在pH试纸中间 |
| B | 加快锌与稀硫酸制取H2的速率 | 在稀硫酸中滴加少量CuSO4溶液 |
| C | 证明醋酸是弱电解质 | 将CH3COONa晶体加入水中,会促进水的电离平衡 |
| D | 制取无色AlCl3 | 加热蒸发AlCl3溶液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1:1 | B、1:3 |
| C、3:1 | D、3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
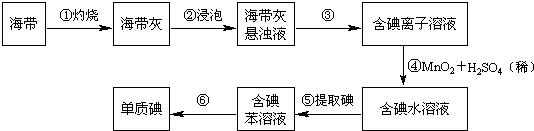
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com