
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是700 mL | |
| B. | 该合金中铜与镁的物质的量之比是2:1 | |
| C. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
分析 A.根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒计算硝酸钠的物质的量,再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的体积;
B.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,根据n=$\frac{m}{M}$计算氢氧根的物质的量,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,根据提供的电子物质的量与二者质量之和列方程计算x、y的值,据此解答;
C.根据c=$\frac{1000ρω}{M}$计算该浓硝酸的物质的量浓度;
D.根据n=$\frac{V}{{V}_{m}}$计算NO2和N2O4混合气体的物质的量,令二氧化氮的物质的量为amol,根据电子转移列放出计算,进而计算二氧化氮的体积分数.
解答 解:A.根据钠离子守恒可知,氢氧化钠的物质的量等于反应后溶液中硝酸钠的物质的量,根据氮元素守恒可知,硝酸钠的物质的量为0.05L×14mol/L-0.04mol-(0.05-0.04)×2=0.64mol,故需要氢氧化钠溶液的体积为$\frac{0.64mol}{1mol/L}$=0.64L=640mL,故A错误;
B.金属离子全部沉淀时,得到2.54g沉淀为氢氧化铜、氢氧化镁,故沉淀中氢氧根的质量为2.54g-1.52g=1.02g,氢氧根的物质的量为:$\frac{1.02g}{17g/mol}$=0.06mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根的物质的量,令铜、镁合金中Cu、Mg的物质的量分别为xmol、ymol,则:2x+2y=0.06、64x+24y=1.52,解得:x=0.02,y=0.01,故合金中铜与镁的物质的量之比是0.02mol:0.01mol=2:1,故B正确;
C.该浓硝酸密度为1.40g/mL、质量分数为63%,故该浓硝酸的物质的量浓度为$\frac{1000×1.4×63%}{63}$mol/L=14mol/L,故C正确;
D.NO2和N2O4混合气体的物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,令二氧化氮的物质的量为amol,则四氧化二氮的物质的量为(0.05-a)mol,根据电子转移守恒可知,a×1+(0.05-a)×2×1=0.06,解得a=0.04,故NO2的体积分数是$\frac{0.04mol}{0.05mol}$×100%=80%,故D正确;
故选A.
点评 本题考查混合物的有关计算,题目难度中等,理解反应发生的过程是关键,是对学生综合能力的考查,注意根据守恒思想进行的解答,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,将相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加Na2S溶液可以得到Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).
为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓;若生成4.29g Cu2(OH)3Cl,则理论上耗氧体积为0.448L(标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物:干冰,冰水混合物,烧碱,小苏打 | |
| B. | 非电解质:乙醇,四氯化碳,氯气,葡萄糖 | |
| C. | 同素异形体:活性炭,C60,C80,金刚石 | |
| D. | 混合物:漂白粉,纯净矿泉水,分析纯盐酸,石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 E的氢化物的电子式
E的氢化物的电子式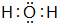 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.27 s | B. | 0.44 s | C. | 1.33 s | D. | 2 s |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com