

 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)分析 (一)由核外电子排布式可知,A为Li、B为O、C为Ne、D为Si、E为Cu;
(1)稀有气体的第一电离能最大;
(2)Cu属于过渡元素;
(3)非金属性越强,电负性越大;
(4)元素之间能形成X2Y型化合物为Li2O、Cu2O;
(二)(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该元素为N元素;
(2)D元素的正三价离子的3d能级为半充满,基态原子外围电子排布为3d64s2;
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子外围电子排布为3d604s1,则E为Cu,为面心立方密堆积;
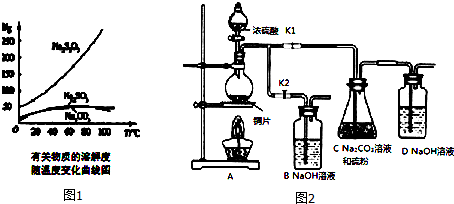
(三)在给出的元素中,c、d均是热和电的良导体,二者为金属,再结合图一,d的熔点比c的高,可知d为Cu,c为Na,由单质的熔点高低的顺序可知a为氢气,b为氮气,e为Si,f为碳单质.
(1)a、f对应的元素以原子个数比1:1形成的分子为乙炔;
(2)a与b的元素形成的10电子中性分子X为NH3,将NH3溶于水后的溶液滴入到AgNO3溶液中至过量,得到配离子[Ag(NH3)2]+;
(3)分子间氢键增大物质熔沸点,而分子内氢键降低物质熔沸点;
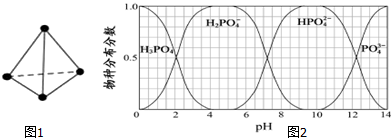
(4)根据图二可知该酸为HNO3,与水分子之间形成氢键,结合相似相溶分析解答.
解答 解:(一)由核外电子排布式可知,A为Li、B为O、C为Ne、D为Si、E为Cu;
(1)稀有气体Ne的第一电离能最大,故答案为:Ne;
(2)Cu属于过渡元素,故答案为:Cu;
(3)上述元素中O元素非金属性最强,故O元素电负性最大,故答案为:O;
(4)元素之间能形成X2Y型化合物为Li2O、Cu2O,故答案为:Li2O、Cu2O;
(二)(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,该元素为N元素,故答案为:N;
(2)D元素的正三价离子的3d能级为半充满,基态原子外围电子排布为3d64s2,D为Fe,价电子排布图为,
故答案为:Fe; ;
;
(3)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,基态原子外围电子排布为3d604s1,则E为Cu,为面心立方最密堆积,空间利用率为74%,
故答案为:面心立方最密;74%;
(三)在给出的元素中,c、d均是热和电的良导体,二者为金属,再结合图一,d的熔点比c的高,可知d为Cu,c为Na,由单质的熔点高低的顺序可知a为氢气,b为氮气,e为Si,f为碳单质.
(1)a、f对应的元素以原子个数比1:1形成的分子为乙炔,乙炔分子中含有2个C-H键和1个-C≡C-,C-H键为δ键,-C≡C-中有1个δ键,2个π键,所以乙炔分子含有3个δ键,2个π键,
故答案为:3; 2;
(2)a与b的元素形成的10电子中性分子X为NH3,空间构型为三角锥型.氨气与AgNO3溶液生成[Ag(NH3)2]+.Ag+提供空轨道,氨气分子提供孤对对子,通过配位键形成[Ag(NH3)2]+,
故答案为:三角锥形;[Ag(NH3)2]+,配位;
(3)前者形成分子间氢键,增大物质熔沸点,而后者分子内氢键,降低物质熔沸点,故前者熔沸点更高,故答案为:高;
(4)根据图二可知该酸为HNO3,HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的-OH易与水分子之间形成氢键,
故答案为:HNO3是极性分子,易溶于极性溶剂水中,HNO3分子中的-OH易与水分子之间形成氢键.
点评 本题是对物质结构与性质的考查,需要学生熟练掌握基础知识并灵活应用,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | NaOH | C. | AgNO3 | D. | BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
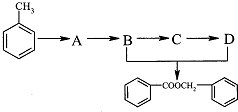
| 编号 | 1 | 2 | 3 | 4 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3:2 | B. | 4:3 | C. | 4:1 | D. | 2:l |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
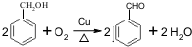
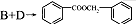 的化学方程式为
的化学方程式为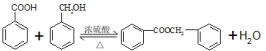
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com