
| A. | C、B、E、D、A | B. | B、D、A、C、E | C. | C、D、E、A、B | D. | C、E、B、D、A |
分析 A、B、C、D、E均为氯的含氧化合物,根据氧化还原反应中Cl元素的化合价升降来分析解答.
解答 解:①B+H2O $\stackrel{电解}{→}$ C+H2↑,H元素的化合价降低,则Cl元素的化合价升高,所以Cl元素的化合价为C>B,
②A→B+NaCl中,NaCl中Cl元素为-1价,则Cl元素的化合价为B>A>-1,
③E+NaOH→B+C+H2O中,结合①可知Cl元素的化合价为C>E>B,
④D+NaOH→A+B+H2O中,结合②可知,Cl元素的化合价为B>D>A,
所以五种化合物中氯的化合价由高到低的顺序为CEBDA,
故选D.
点评 本题考查氧化还原反应,明确氧化还原反应中元素的化合价变化是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 5 | B. | 6 | C. | 7 | D. | 8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X>Y,则酸性:HA>HB | |
| B. | 若X=Y,则HB一定是强酸 | |
| C. | 若酸性:HA<HB,则X和Y关系不确定 | |
| D. | 若由水电离出的H+的浓度:(I)>(Ⅱ),则是X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-.
,其所含有的官能团有(写结构简式)-$\underset{\stackrel{\;}{C}}{|}=O$、-OH、C=C、-O-. .这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.
.这种药物的研制是基于获得2000年诺贝尔生理学和医学奖的研究成果.L-多巴分子中所含的官能团的名称是羟基、氨基和羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
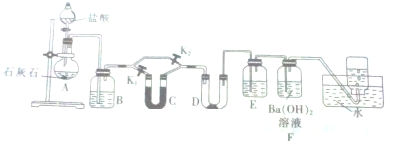
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com