
| A. | 盐酸滴在大理石上:2H++CO32-═CO2↑+H2O | |
| B. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| C. | 向NaOH溶液中通入过量CO2:OH-+CO2═HCO3- | |
| D. | 氢氧化钙与过量NaHCO3溶液反应:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.碳酸钙在离子反应中保留化学式;
B.Cu与稀硫酸不反应;
C.反应生成碳酸氢钠;
D.氢氧化钙完全反应,反应生成碳酸钙、碳酸钠、水.
解答 解:A.盐酸滴在大理石上的离子反应为2H++CaCO3═Ca2++CO2↑+H2O,故A错误;
B.稀硫酸滴在铜片上,不发生反应,故B错误;
C.向NaOH溶液中通入过量CO2的离子反应为OH-+CO2═HCO3-,故C正确;
D.氢氧化钙与过量NaHCO3溶液反应的离子反应为Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 火药使用 | 粮食酿酒 | 转轮排字 | 铁的冶炼 |
 |  |  |  |
| 用品 |  |  |  |  |
| 有效成分 | NaCl | NaOH | NaHCO3 | Ca(ClO)2 |
| 用途 | 做调味品 | 做治疗胃病的抗酸药 | 做发酵粉 | 做消毒剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,32 g氧气和臭氧混合气体中所含有的氧原子数为2NA | |
| B. | 标准状况下,22.4 L水所含的原子数为3NA | |
| C. | 1mol•L-1 Na2 CO3溶液中含有的钠离子数为2NA | |
| D. | 5.6 g铁与足量的盐酸反应失去的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 氢氰酸(HCN) | 碳酸(H2C03) | 氢氟酸(HF) |
| K=6.2×10-10 | K=4.2×10-7 | K=6.61×10-4 |
| A. | 氟化钠溶液中通入C02:2F-+H2O+CO2═2HF+CO32- | |
| B. | NaCN与HCN的混合溶液中:2c(Na+)═c(CN-)+c(HCN) | |
| C. | 25℃时同浓度的NaCN和NaF溶液的pH值前者小于后者 | |
| D. | 三种酸的酸性由强到弱为:HF>H2C03>HCN |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 57.5mL | B. | 55mL | C. | 52.5mL | D. | 50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12g石墨和C60的混合固体中,含NA个碳原子 | |
| B. | 标准状况下,2.24L水中含有0.1NA个水分子 | |
| C. | 7.8g过氧化钠含有的阴离子数为0.2NA | |
| D. | 0.1mol铁在足量氯气中燃烧,电子转移数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
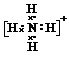 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com