
【题目】有600 mL某种混合物溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现将此溶液分成三等份,进行如下实验:
(1)向第一份中加入AgNO3溶液,有沉淀产生;
(2)向第二份中加足量NaOH溶液并加热后,收集到气体0.04 mol;
(3)向第三份中加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。 根据上述实验现象,以下推测正确的是
A. K+不一定存在 B. Ba2+、Mg2+不一定都存在
C. Cl-不一定存在 D. 混合溶液中CO32-的浓度为0.2 mol/L
【答案】C
【解析】第一份加入AgNO3溶液有沉淀产生,可能发生Cl-+Ag+=AgCl↓、CO32-+2Ag+=Ag2CO3↓、SO42-+2Ag+=Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-;第二份加足量NaOH溶液加热后,收集到气体0.04mol,能和NaOH溶液加热产生气体的只能是NH4+,则一定含有NH4+,根据反应NH4++OH-![]() NH3+H2O可知,产生NH3为0.04mol,则NH4+也为0.04mol;第三份加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g,说明有部分沉淀溶于盐酸、部分沉淀不溶于盐酸,则沉淀为BaCO3和BaSO4,溶液中一定存在CO32-、SO42-,一定不存在Ba2+,由条件可知BaSO4为2.33g,物质的量为2.33g÷233g/mol=0.01mol,BaCO3为6.27g-2.33g=3.94g,物质的量为3.94g÷197g/mol=0.02mol,则CO32-物质的量为0.02mol,CO32-物质的量浓度为0.02mol÷0.2L=0.1mol/L。A. CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒可知,K+一定存在,且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须存在Cl-,故A错误;B. 溶液中一定存在CO32-、SO42-,因Ba2+和CO32-、SO42-可发生反应生成BaCO3和BaSO4沉淀,Mg2+和CO32-可发生反应生成MgCO3沉淀,因此Mg2+和Ba2+一定不存在,故B错误;C. 根据A项分析可知,只有当K+物质的量>0.02mol时,溶液中才必须存在Cl-,所以不能确定溶液中Cl-是否存在,故C正确;D. 由上述分析可知,溶液中CO32-的物质的量浓度为0.1mol/L,故D错误;答案选C。
NH3+H2O可知,产生NH3为0.04mol,则NH4+也为0.04mol;第三份加足量BaCl2溶液后,得干燥的沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g,说明有部分沉淀溶于盐酸、部分沉淀不溶于盐酸,则沉淀为BaCO3和BaSO4,溶液中一定存在CO32-、SO42-,一定不存在Ba2+,由条件可知BaSO4为2.33g,物质的量为2.33g÷233g/mol=0.01mol,BaCO3为6.27g-2.33g=3.94g,物质的量为3.94g÷197g/mol=0.02mol,则CO32-物质的量为0.02mol,CO32-物质的量浓度为0.02mol÷0.2L=0.1mol/L。A. CO32-、SO42-、NH4+物质的量分别为0.02mol、0.01mol、0.04mol,CO32-、SO42-所带负电荷分别为0.02mol×2、0.01mol×2,共0.06mol,NH4+所带正电荷为0.04mol,根据溶液中电荷守恒可知,K+一定存在,且K+物质的量≥0.02mol,当K+物质的量>0.02mol时,溶液中还必须存在Cl-,故A错误;B. 溶液中一定存在CO32-、SO42-,因Ba2+和CO32-、SO42-可发生反应生成BaCO3和BaSO4沉淀,Mg2+和CO32-可发生反应生成MgCO3沉淀,因此Mg2+和Ba2+一定不存在,故B错误;C. 根据A项分析可知,只有当K+物质的量>0.02mol时,溶液中才必须存在Cl-,所以不能确定溶液中Cl-是否存在,故C正确;D. 由上述分析可知,溶液中CO32-的物质的量浓度为0.1mol/L,故D错误;答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,把溴置换出来,再用空气将嗅吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及的反应有①_________________(写出化学方程式);②3Br2+3CO![]() ===BrO
===BrO![]() +5Br-+3CO2↑;③BrO
+5Br-+3CO2↑;③BrO![]() +5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
+5Br-+6H+===3Br2+3H2O。其中反应②中氧化剂是________;还原剂是________。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的化学方程式:______________________。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是________。下列可以用于海水中溴的萃取的溶剂是________(填序号)。
①乙醇 ②四氯化碳 ③硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种无色溶液,它们分别为葡萄糖溶液、蔗糖溶液、淀粉溶液中的一种,经实验可知:
①B能发生银镜反应;②A遇碘水变蓝色;③A、C均能发生水解反应,水解液均能发生银镜反应。
(1)试判断它们各是什么物质:
A是________,B是________,C是________。
(2)分别写出A、C发生水解反应的化学方程式:
A:___________________________。
C:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某液态烃的分子式为CmHn,相对分子质量为H2的39倍。它不能使酸性KMnO4溶液褪色,不能同溴的四氯化碳溶液反应而使其褪色。在催化剂存在时,7.8 g 该烃能与0.3 mol H2发生加成反应生成相应的饱和烃CmHp。则:
(1)m、n、p的值分别是m=________,n=________,p=________。
(2)CmHp的结构简式是:________。
(3)CmHn能和浓硫酸、浓硝酸的混合酸反应,该反应的化学方程式是________________,该反应属于__________反应,有机产物的名称是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知乙烯能发生以下转化:

(1)乙烯的结构简式为___________。
(2)②的反应类型___________。
(3)写出①的化学方程式___________。
(4)写出②的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醛(在水中溶解度不大,易溶于有机溶剂,密度约等于水的密度)、苯甲酸。反应原理如下:
2C6H5CHO+NaOH![]() C6H5CH2OH+C6H5COONa
C6H5CH2OH+C6H5COONa
C6H5COONa+HCl![]() C6H5COOH+NaCl
C6H5COOH+NaCl
相关物质物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 122 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如下:

(1)第Ⅰ步需连续加热1小时(如图1),其中加热混合固定装置为画出。
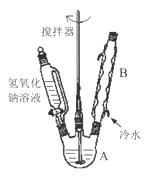
仪器A的名称为_______,若将仪器B改为仪器C,效果不如B,说明原因:_______。
(2)操作②有关分液漏斗的使用不正确的是_______
A.分液漏斗在使用之前必须检验是否漏水
B.分液漏斗内的液体不能过多,否则不利于振荡
C.充分振荡后将分液漏斗置于铁架台上静置,分层后立即打开旋塞进行分液
D.分液时待下层液体放完后立即关闭旋塞,换掉烧杯再打开旋塞使上层液体流下
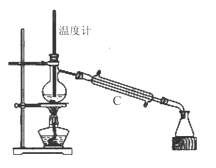
(3)操作③是用沸水浴加热蒸馏,再进行操作④(如图2),收集______℃的馏分。图2中有一处明显错误,正确的应改为_____________。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用_____冲洗杯壁上残留的晶体。抽滤完成后用少量冰水对晶体进行洗涤,洗涤应____________。
(5)用电子天平准确称取0.2440g苯甲酸于锥形瓶中加100mL蒸馏水溶解(必要时可以加热),再用0.1000mol/L的标准氢氧化钠溶液滴定,共消耗标准氢氧化钠溶液19.20mL,苯甲酸的纯度为_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式
(1)钠在空气中加热__________________________________
(2)工业制漂白粉__________________________________
(3)氯气通入水中__________________________________
(4)次氯酸见光分解__________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,对于密闭容器中进行的可逆反应A(g)+3B(g)![]() 2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
2C(g),下列说法中,能说明这一反应已经达到化学平衡状态的是( )
A.生成C的速率与C分解的速率相等
B.A、B、C的浓度相等
C.单位时间生成n mol A,同时生成3n mol B
D.A、B、C的分子数之比为1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
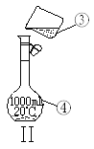
【题目】下图为两套实验装置。
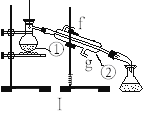
⑴写出下列仪器的名称: ①________________;②________________ 。
⑵仪器①~④中,使用时必须检查是否漏水的有_____________。(填序号)
⑶若利用装置I制取蒸馏水,还缺少的仪器是_____________,将仪器补充完整后进行实验,冷却水从_______口进。
⑷现需配制1.0 mol·L-1的NaOH溶液240mL,其中装置II是某同学配制此溶液时转移操作的示意图,图中有两处错误分别是 ___________________ 、_____________________ 。
⑸配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却
其正确的操作顺序为_____________________。
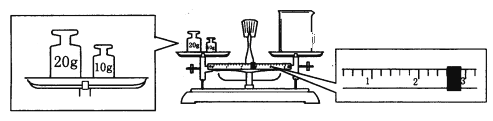
⑹某同学欲称量一定量的NaOH固体,他先用托盘天平称量烧杯的质量,天平平衡后的状态如图。烧杯的实际质量为______g,该同学应称量______g NaOH。
⑺在配制过程中,如果其他操作都是正确的,下列操作会引起浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量溶液洒到容量瓶外面 ③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线 ⑤定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com