
【题目】常温下,某学生从一种强酸性的未知无色溶液中检出Ag+,他还想通过实验检验溶液中是否含有大量的NO3-、Cl-、CO32-、Cu2+、Fe3+、K+等。一定存在的离子是_______;一定不存在的离子是_______;不能确定是否存在的离子是____________。
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】下列中学化学中常见物质的转化关系图中,反应条件及部分反应物和产物未全部注明,已知A,D为金属单质,其他为化合物. 
试推断:
(1)写出物质的化学式:A:、C:、I: .
(2)写出下列反应的方程式:
C→F的离子方程式 .
H→I的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应2KMnO4 = K2MnO4 + MnO2 + O2↑中,氧化产物是( )
A. K2MnO4 B. MnO2 C. KMnO4 D. O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

回答下列问题:
(1)写出Mg2B2O5H2O与硫酸反应的化学方程式___________________________。为提高浸出速率,除适当增加硫酸浓度外,还可采取的措施有___________________________(写出两条)。
(2)利用____________的磁性,可将其从“浸渣”中分离。“浸渣”中还剩余的物质是_______________。(化学式)
(3)“净化除杂”需先加H2O2溶液,作用是__________________________。然后再调节溶液的pH约为5,目的是__________________________。
(4)“粗硼酸”中的主要杂质是_____________ (填化学式)。
(5)以硼酸为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,其电子式为____________。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料可制备单质硼,用化学方程式表示制备过程________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向a mL 0.10mol/L的稀氨水中逐滴加入 b mL 0.10mol/L的稀盐酸,试分析:
(1)当b=a时,溶液呈(填“酸”“碱”或“中”)性,此时溶液中,c( ![]() )(填“>”“<”或“=”)c(Cl﹣).
)(填“>”“<”或“=”)c(Cl﹣).
(2)当溶液呈中性时,a(填“>”“<”或“=”)b,此时溶液中c( ![]() )c(Cl﹣)(同上).
)c(Cl﹣)(同上).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,固定容积的密闭容器中,CO和H2反应生成甲醇:CO(g)+2H2(g)![]() CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是
CH3OH(g).如图是该反应在不同温度下CO的转化率随时间变化的曲线.下列判断正确的是
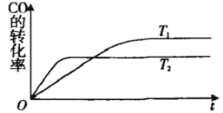
A.T1>T2,该反应的△H>0
B.加入催化剂可以提高CO的转化率
C.T1时的平衡常数时的平衡常数K1>T2时的平衡常数K2
D.温度降低,CO(g)+2H2(g)![]() CH3OH(I)的△H值将变大
CH3OH(I)的△H值将变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果2 mol物质A的质量为56g,则物质A的摩尔质量是__________ ,
42g 物质A的物质的量是________ ,0.5 mol物质A的质量是_________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是科学研究的重要方法,下列物质分类不正确的是
A.酸性氧化物一定是金属氧化物B.同素异形体:活性炭、C60、金刚石
C.非电解质:乙醇、四氯化碳、氯气D.混合物:漂白粉、纯净矿泉水、盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含等物质的量NaOH的溶液分别用pH为2和3的CH2COOH溶液中和,设消耗CH2COOH溶液的体积依次为Va、Vb,两者的关系正确的是
A. Va>10Vb B. Va=10Vb C. Va<10Vb D. Va>10Vb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com