
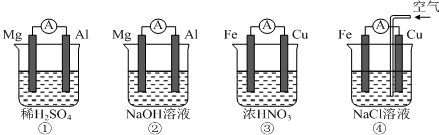
| A. | ①中Mg作负极,电子流向:Mg→稀硫酸→Al | |
| B. | ②中Al作负极,OH?迁移方向:Al→外电路→Mg | |
| C. | ③中Fe作正极,电极反应式:2H++2e?═H2↑ | |
| D. | ④中Cu作正极,电极反应式:O2+4e?+2H2O═4OH? |
分析 A.电子不流经溶液;
B.离子不能经过外电路;
C.铜作负极发生氧化反应,硝酸被还原生成二氧化氮气体;
D.铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀.
解答 解:A.电子不流经溶液,只能从负极经外电路流向正极,故A错误;
B.离子不能经过外电路,故B错误;
C.铁与浓硝酸发生钝化反应,铁为正极,铜作负极发生氧化反应,正极上硝酸被还原生成二氧化氮气体,故C错误;
D.铁、铜、氯化钠构成的原电池中,金属铁发生的是吸氧腐蚀,铜为正极,铁为负极,正极发生O2+4e?+2H2O═4OH?,故D正确.
故选D.
点评 本题考查原电池知识,为高频考点,明确各个电极上发生的反应是解本题关键,难点是电极反应式的书写,注意②③中正负极的判断,不能根据金属的活泼性强弱判断正负极,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
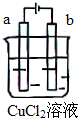
| A. | 电极a表面呈红色 | |
| B. | 电极b表面有气泡生成 | |
| C. | 电子由电源的负极沿导线流向电极b | |
| D. | 该装置能量转化形式为化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
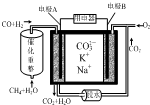
| A. | 电极A为正极,发生了还原反应 | |
| B. | 电极A上CO参与的电极反应为:CO+O2--2e-═CO2 | |
| C. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| D. | 电池工作时,K+向电极A移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
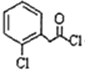
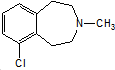 )一种治疗心血管和高血压的药物,可由化合物B(
)一种治疗心血管和高血压的药物,可由化合物B( )通过以下路线合成:
)通过以下路线合成: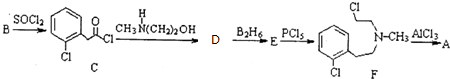
 +CH3NH(CH2)2OH→
+CH3NH(CH2)2OH→ +HCl.
+HCl. .由F生成A的反应类型为取代反应.
.由F生成A的反应类型为取代反应. 或
或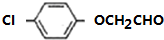 .
.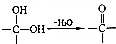 .写出以
.写出以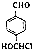 为原料制备化合物
为原料制备化合物 的合成路线流程图.
的合成路线流程图. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
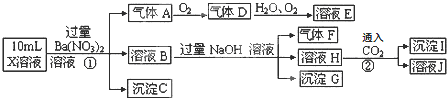
| A. | 气体F不能与溶液E发生反应 | |
| B. | X中肯定存在Fe2+、Al3+、NH4+、SO42- | |
| C. | X中肯定不存在CO32-、SO32-、Cl- | |
| D. | X中不能确定的离子是Al3+和Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com