
| A. | ③④⑤⑥ | B. | ①③④⑤ | C. | ①②③⑥⑦ | D. | ①②③④⑤⑥ |
科目:高中化学 来源: 题型:解答题
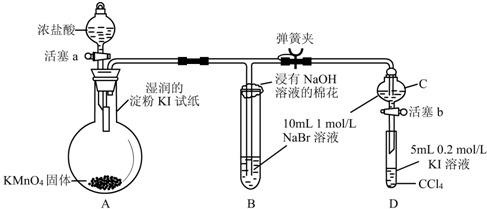
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
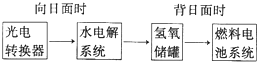
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10℃时,1LpH=1.0的H2SO4溶液中含H+为0.1NA | |
| B. | 常温下,14g的146C含中子数目为6NA | |
| C. | 标况下,11.2LNO与11.2LO2混合,原子总数小于2NA | |
| D. | 0.1mol苯乙烯含碳碳双键为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:
元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表.有一种非常有趣的商业周期表如图所示.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

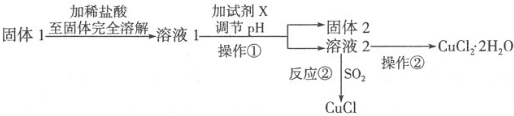
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
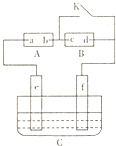 如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:
如图A为直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;其反应类型是消去反应.
;其反应类型是消去反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com