
(15·Ö)CaO2ÄŃČÜÓŚĖ®£¬ČÜÓŚĖįÉś³É¹żŃõ»ÆĒā£¬ŌŚŅ½Ņ©ÉĻÓĆ×÷ɱ¾ś¼Į”¢·ĄøƼĮµČ”£
¢ń£®CaO2ÖʱøŌĄķ£ŗCa(OH)2(s)£«H2O2(aq)£½CaO2(s)£«2H2O(l)£»¦¤H£¼0
²»Ķ¬ÅØ¶ČµÄH2O2¶Ō·“Ӧɜ³ÉCaO2²śĀŹµÄÓ°ĻģČēĻĀ±ķ£ŗ
H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
£Ø1£©·ÖĪöĢāøųŠÅĻ¢£¬½āŹĶH2O2ÅØ¶Č“óÓŚ20%ŗóCaO2²śĀŹ·“¶ų¼õŠ”µÄŌŅņ£ŗ____”£
¢ņ£®¹żŃõ»ÆøĘÖŠ³£ŗ¬ÓŠCaOŌÓÖŹ£¬ŹµŃéŹŅæÉ°“ŅŌĻĀ²½Öč²ā¶ØCaO2ŗ¬Į攣
²½Öč1£ŗ×¼Č·³ĘČ”0.04”«0.05 g¹żŃõ»ÆøĘѳʷ£¬ÖĆÓŚ250 mLµÄ׶ŠĪĘæÖŠ£»
²½Öč2£ŗ·Ö±š¼ÓČė30 mLÕōĮóĖ®ŗĶ2 mLŃĪĖį(3 mol”¤L£1)£¬Õńµ“Ź¹Ö®Čܽā£»
²½Öč3£ŗĻņ׶ŠĪĘæÖŠ¼ÓČė5 mL KIČÜŅŗ(100 g”¤L£1)£»
²½Öč4£ŗÓĆĮņ“śĮņĖįÄʱź×¼ČÜŅŗµĪ¶Ø£¬ÖĮČÜŅŗ³ŹĒ³»ĘÉ«£¬Č»ŗó________£¬ÓĆĮņ“śĮņĖįÄʱź×¼ČÜŅŗ¼ĢŠųµĪ¶Ø£¬________£¬¼ĒĀ¼Źż¾Ż£»
²½Öč5£ŗĘ½ŠŠ²ā¶Ø3“Ī£¬¼ĘĖćŹŌŃłÖŠCaO2µÄÖŹĮæ·ÖŹż”£µĪ¶ØŹ±·¢ÉśµÄ·“Ó¦ĪŖ2Na2S2O3£«I2===Na2S4O6£«2NaI”£
£Ø2£©¹żŃõ»ÆøĘČܽāŹ±Ń”ÓĆŃĪĖį¶ų²»Ń”ÓĆĮņĖįČÜŅŗµÄŌŅņŹĒ____”£
£Ø3£©¼ÓČėKIČÜŅŗŗó·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ____”£
£Ø4£©Ēė²¹³äĶźÕūŹµŃé²½Öč4ÖŠµÄÄŚČŻ£ŗ____________£»____________”£
¢ó£®²ā¶Øŗ¬ÓŠCaOŌÓÖŹµÄCaO2ŗ¬ĮæµÄŹµŃé·½·Ø½Ļ¶ą£¬Ä³Ķ¬Ń§Éč¼ĘĮĖ½öÓĆĻ”ŃĪĖįŅ»ÖÖŅ©Ę·(ŅĒĘ÷æÉČĪŃ”)½ĻĪŖ×¼Č·µŲ²ā³öCaO2ŗ¬ĮæµÄŹµŃ飬ĒėÄć°ļøĆĶ¬Ń§ĮŠ³öĖłŠčŅĒĘ÷Ē嵄(ŹµŃéÓĆĘ·ŗĶÓĆÓŚ¹Ģ¶ØµÄ»ņĮ¬½ÓµÄŅĒĘ÷æɲ»Š“)”£
£Ø5£©ŅĒĘ÷£ŗ________________________”£
 ČŹ°®Ó¢ÓļĶ¬²½Į·Ļ°²įĻµĮŠ“š°ø
ČŹ°®Ó¢ÓļĶ¬²½Į·Ļ°²įĻµĮŠ“š°ø ѧĻ°Źµ¼łŌ°µŲĻµĮŠ“š°ø
ѧĻ°Źµ¼łŌ°µŲĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015Ń§ÄźÉ½¶«ĘėĀ³ĆūŠ£½ĢæĘŃŠŠ×÷Ģå19ĖłĆūŠ£øßČżµŚ¶ž“Īµ÷ŃŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗĢīæÕĢā
(8·Ö)ŃŠ¾æ»Æѧ·“Ó¦ŌĄķ¶ŌÓŚÉś²ś”¢Éś»ī¼°»·¾³±£»¤¾ßÓŠÖŲŅŖŅāŅ唣
£Ø1£©ÓĆH2O2ŗĶH2SO4µÄ»ģŗĻČÜŅŗæÉČܳöÓ”Ė¢µēĀ·°å½šŹō·ŪÄ©ÖŠµÄĶ”£ŅŃÖŖ£ŗ
Cu£Øs£©+2H+£Øaq£©£½Cu2+£Øaq£©+H2£Øg£© ”÷H£½£«64.39kJmol-1
2H2O2£Øl£©£½2H2O£Øl£©+O2£Øg£© ”÷H£½-196.46kJmol-1
H2£Øg£©+1/2O2£Øg£©£½H2O£Øl£© ”÷H£½-285.84kJmol-1
ŌŚH2SO4ČÜŅŗÖŠCuÓėH2 O2·“Ӧɜ³ÉCu2+ŗĶH2OµÄČČ»Æѧ·½³ĢŹ½ĪŖ______________”£
O2·“Ӧɜ³ÉCu2+ŗĶH2OµÄČČ»Æѧ·½³ĢŹ½ĪŖ______________”£
£Ø2£©Ä³·“Ó¦ÖŠ·“Ó¦ĪļÓėÉś³ÉĪļÓŠ£ŗAsH3”¢H2SO4”¢KBrO3”¢K2SO4”¢H3AsO4”¢H2OŗĶŅ»ÖÖĪ“ÖŖĪļÖŹX”£
¢ŁŅŃÖŖ0.4 mol KB rO3ŌŚ·“Ó¦ÖŠµĆµ½2 molµē×ÓÉś³ÉX£¬ŌņXµÄ»ÆѧŹ½ĪŖ_______£»øĆ·“Ó¦µÄ»¹Ō¼Į¼°ĘäÅäĘ½ŗóµÄĻµŹżŹĒ_____”£
rO3ŌŚ·“Ó¦ÖŠµĆµ½2 molµē×ÓÉś³ÉX£¬ŌņXµÄ»ÆѧŹ½ĪŖ_______£»øĆ·“Ó¦µÄ»¹Ō¼Į¼°ĘäÅäĘ½ŗóµÄĻµŹżŹĒ_____”£
¢Śøł¾ŻÉĻŹö·“Ó¦æÉĶĘÖŖ_______”£
a£®Ńõ»ÆŠŌ£ŗKBrO3£¾H3AsO4
b£®Ńõ»ÆŠŌ£ŗH3AsO4£¾KBrO3
c£®»¹ŌŠŌ£ŗAsH3£¾X
d£®»¹ŌŠŌ£ŗX£¾AsH3
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015Ń§ÄźÉ½¶«Ź”¼ĆÄžŹŠøßČżµŚ¶ž“ĪÄ£Äā»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÉčNAĪŖ°¢·ü¼ÓµĀĀŽ³£ŹżµÄÖµ”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®³£ĪĀĻĀ£¬0£®05 mol”¤L£1Fe2£ØSO4£©3ČÜŅŗÖŠŗ¬Fe3+ŹżÄæŠ”ÓŚ0£®1 NA
B£®30g¼×Č©ÖŠŗ¬µē×Ó¶ŌŹżĪŖ4NA
C£®12 gŹÆÄ«Ļ©£Øµ„²ćŹÆÄ«£©ÖŠŗ¬ÓŠĮłŌŖ»·µÄøöŹżŹĒ0£®5NA
D£®ŹŅĪĀĻĀ£¬7£®1 gĀČĘųÓė×ćĮæŹÆ»ŅČé³ä·Ö·“Ó¦×ŖŅʵē×ÓŹżŠ”ÓŚ0£®1 NA
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğĞĻÄŅų“ØŹŠ”¢ŹÆ×ģɽŹŠøßČżĖÄŌĀĮŖæ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ¼ņ“šĢā
£Ø13·Ö£©·ĻĘśĪļµÄ×ŪŗĻĄūÓĆ¼ČÓŠĄūÓŚ½ŚŌ¼×ŹŌ“£¬ÓÖÓŠĄūÓŚ±£»¤»·¾³”£ŹµŃéŹŅĄūÓĆ·Ļ¾É»ĘĶ(Cu”¢ZnŗĻ½š£¬ŗ¬ÉŁĮæŌÓÖŹFe)ÖʱøµØ·Æ¾§Ģå(CuSO4”¤5H2O)¼°ø±²śĪļZnO”£ÖʱøĮ÷³ĢĶ¼ČēĻĀ£ŗ
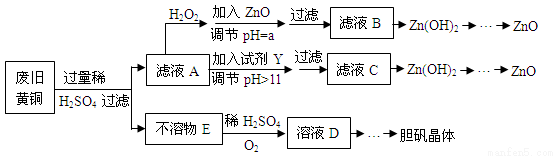
ŅŃÖŖ£ŗZn¼°»ÆŗĻĪļµÄŠŌÖŹÓėAl¼°»ÆŗĻĪļµÄŠŌÖŹĻąĖĘ£¬pH£¾11Ź±Zn(OH)2ÄÜČÜÓŚNaOHČÜŅŗÉś³É[Zn(OH)4]2-”£ĻĀ±ķĮŠ³öĮĖ¼øÖÖĄė×ÓÉś³ÉĒāŃõ»ÆĪļ³ĮµķµÄpH(æŖŹ¼³ĮµķµÄpH°“½šŹōĄė×ÓÅضČĪŖ1.0mol/L¼ĘĖć)”£
Fe3£« | Fe2£« | Zn2£« | |
æŖŹ¼³ĮµķµÄpH | 1.1 | 5.8 | 5.9 |
³ĮµķĶźČ«µÄpH | 3.0 | 8.8 | 8.9 |
Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©¼ÓČėZnOµ÷½ŚpH£½aµÄÄæµÄŹĒ___________________,aµÄ·¶Ī§ŹĒ ”£
£Ø2£©Óɲ»ČÜĪļEÉś³ÉČÜŅŗDµÄ»Æѧ·½³ĢŹ½ĪŖ______________________________”£
£Ø3£©ĀĖŅŗAÖŠ¼ÓČėH2O2·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
£Ø4£©ÓÉČÜŅŗDÖĘµØ·Æ¾§Ģå°üŗ¬µÄÖ÷ŅŖ²Ł×÷²½ÖčŹĒ ”£
£Ø5£©ĻĀĮŠŹŌ¼ĮæÉ×÷ĪŖYŹŌ¼ĮµÄŹĒ______”£
A£®ZnO B£®NaOH C£®Na2CO3 D£®ZnSO4
ČōŌŚĀĖŅŗCÖŠÖšµĪ¼ÓČėŃĪĖįÖ±µ½¹żĮ棬Ōņ²śÉśµÄĻÖĻóŹĒ___________________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğĞĻÄŅų“ØŹŠ”¢ŹÆ×ģɽŹŠøßČżĖÄŌĀĮŖæ¼Ąķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®µķ·Ū”¢ĻĖĪ¬ĖŲŗĶÓĶÖ¬¶¼ŹĒĢģČ»øß·Ö×Ó»ÆŗĻĪļ
B£®ŅŅĖįŅŅõ„ŌŚ¼īŠŌĢõ¼žĻĀµÄĖ®½ā·“Ó¦³ĘĪŖŌķ»Æ·“Ó¦
C£®ŅŅ“¼ÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬·¢ÉśµÄŹĒŃõ»Æ·“Ó¦
D£®ŅŅĻ©æÉŅŌÓėĒāĘų·¢Éś¼Ó³É·“Ó¦£¬±½²»ÄÜÓėĒāĘų¼Ó³É
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğ½ĖÕŹ”Ģ©ÖŻŹŠøßČżµŚ¶ž“ĪÄ£Äāæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
³ōŃõŹĒĄķĻėµÄŃĢĘųĶŃĻõ¼Į£¬ĘäĶŃĻõ·“Ó¦ĪŖ2NO2(g)£«O3(g) N2O5(g)£«O2(g)£¬ŌŚTĪĀ¶ČĻĀ£¬Ļņ2.0 LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė2.0 mol NO2ŗĶ1.0 mol O3£¬¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
N2O5(g)£«O2(g)£¬ŌŚTĪĀ¶ČĻĀ£¬Ļņ2.0 LŗćČŻĆܱÕČŻĘ÷ÖŠ³äČė2.0 mol NO2ŗĶ1.0 mol O3£¬¾¹żŅ»¶ĪŹ±¼äŗó“ļµ½Ę½ŗā”£·“Ó¦¹ż³ĢÖŠ²ā¶ØµÄ²æ·ÖŹż¾Ż¼ūĻĀ±ķ£ŗ
t/s | 0 | 3 | 6 | 12 | 24 |
n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
ĻĀĮŠÓŠ¹ŲĖµ·ØÕżČ·µÄŹĒ
A£®·“Ó¦ŌŚ0”«3 sÄŚµÄĘ½¾łĖŁĀŹv(NO2)£½0.24 mol”¤L£1”¤s£1
B£®24 sŗó£¬Čō±£³ÖĘäĖūĢõ¼ž²»±ä£¬½µµĶĪĀ¶Č£¬“ļµ½ŠĀĘ½ŗāŹ±²āµĆc(O2)£½0.44 mol”¤L£1£¬Ōņ·“Ó¦µÄ¦¤H£¼0
C£®ŌŚTĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė1.0 mol NO2”¢0.5 mol O3ŗĶ0.50 mol N2O5”¢0.50 mol O2£¬·“Ó¦“ļµ½Ę½ŗāŹ±£¬Ń¹ĒæĪŖĘšŹ¼Ź±µÄ0.88±¶
D£®ŌŚTĪĀ¶ČĻĀ£¬ĘšŹ¼Ź±ĻņČŻĘ÷ÖŠ³äČė2.0 mol N2O5ŗĶ2.0 mol O2£¬“ļµ½Ę½ŗāŹ±£¬N2O5µÄ×Ŗ»ÆĀŹ“óÓŚ20%
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğ½ĖÕŹ”Ģ©ÖŻŹŠøßČżµŚ¶ž“ĪÄ£Äāæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
ÓĆĻĀĮŠ×°ÖĆ½ųŠŠĻąÓ¦ŹµŃ飬ÄÜ“ļµ½ŹµŃéÄæµÄµÄŹĒ

A£®ÓĆĶ¼1ĖłŹ¾ÅäÖĘŅ»¶ØÅØ¶ČµÄĻ”ĮņĖį
B£®ÓĆĶ¼2×°ÖĆŹµŃéŹŅÖĘČ”°±Ęų
C£®ÓĆĶ¼3×°ÖĆÕō·¢±„ŗĶŹ³ŃĪĖ®
D£®ÓĆĶ¼4×°ÖĆÖĘČ””¢ŹÕ¼ÆŅŅČ²ĘųĢå
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğ½ĖÕŹ”ÄĻĶØ”¢ŃļÖŻ”¢Į¬ŌĘøŪøßČżµŚ¶ž“Īµ÷ŃŠ²āŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
»ÆŗĻĪļM¾ßÓŠ¹ćĘ×æ¹¾ś»īŠŌ£¬ŗĻ³ÉMµÄ·“Ó¦æɱķŹ¾ČēĻĀ£ŗ
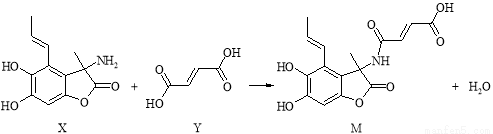
ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
A£®X·Ö×ÓÖŠÓŠ2øöŹÖŠŌĢ¼Ō×Ó
B£®Y·Ö×ÓÖŠĖłÓŠŌ×ÓæÉÄÜŌŚĶ¬Ņ»Ę½ĆęÄŚ
C£®æÉÓĆFeCl3ČÜŅŗ»ņNaHCO3ČÜŅŗ¼ų±šXŗĶY
D£®ŌŚNaOHČÜŅŗÖŠ£¬1 mol M×ī¶ąæÉÓė5 mol NaOH·¢Éś·“Ó¦
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2014-2015ѧğŗžÄĻŹ”»³»ÆŹŠøßČżµŚ¶ž“ĪÄ£Äāæ¼ŹŌĄķ×Ū»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗ¼ņ“šĢā
(14·Ö)¹¤ŅµÉś²śÖŠ²śÉśµÄSO2”¢NOÖ±½ÓÅŷŽ«¶Ō“óĘųŌģ³ÉŃĻÖŲĪŪČ¾”£ĄūÓƵē»ÆѧŌĄķĪüŹÕSO2ŗĶNO£¬Ķ¬Ź±»ńµĆ Na2S2O4ŗĶ NH4NO3²śĘ·µÄ¹¤ŅÕĮ÷³ĢĶ¼ČēĻĀ(CeĪŖīęŌŖĖŲ)”£
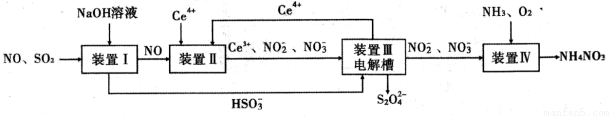
Ēė»Ų“šĻĀĮŠĪŹĢā”£
£Ø1£©×°ÖĆ¢ņÖŠNOŌŚĖįŠŌĢõ¼žĻĀÉś³ÉNO2”ŖµÄĄė×Ó·½³ĢŹ½ ”£
£Ø2£©ŗ¬Įņø÷Ī¢Į£(H2SO3”¢HSO3”ŖŗĶSO32”Ŗ)“ęŌŚÓŚSO2ÓėNaOHČÜŅŗ·“Ó¦ŗóµÄČÜŅŗÖŠ£¬ĖüĆĒµÄĪļÖŹµÄĮæ·ÖŹż¦ŲÓėČÜŅŗpHµÄ¹ŲĻµČēĻĀĶ¼ĖłŹ¾”£
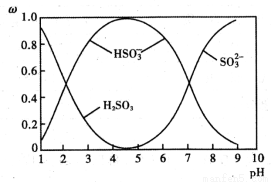
¢ŁĻĀĮŠĖµ·ØÕżČ·µÄŹĒ £ØĢī±źŗÅ£©”£
A.pH£½7Ź±£¬ČÜŅŗÖŠc( Na+)£¼c (HSO£3) + c(SO2£3)
B.ÓÉĶ¼ÖŠŹż¾Ż£¬æÉŅŌ¹ĄĖć³öH2SO3µÄµŚ¶ž¼¶µēĄėĘ½ŗā³£ŹżKa2”Ö10£7
C.ĪŖ»ńµĆ¾”æÉÄÜ“æµÄ NaHSO3£¬Ó¦½«ČÜŅŗµÄpHæŲÖĘŌŚ 4”«5ĪŖŅĖ
D.pH£½2ŗĶ pH£½9Ź±µÄČÜŅŗÖŠĖłŗ¬Į£×ÓÖÖĄą²»Ķ¬
¢ŚČō1L1mol/LµÄNaOHČÜŅŗĶźČ«ĪüŹÕ13.44L£Ø±źæöĻĀ£©SO2£¬Ōņ·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ ”£
¢ŪČ”×°ÖĆ¢ńÖŠµÄĪüŹÕŅŗvmL£¬ÓĆcmol/LµÄĖįŠŌøßĆĢĖį¼ŲČÜŅŗµĪ¶Ø”£ĖįŠŌøßĆĢĖį¼ŲČÜŅŗӦװŌŚ £ØĢī”°ĖįŹ½”±»ņ”°¼īŹ½”±£©µĪ¶Ø¹ÜÖŠ£¬ÅŠ¶ĻµĪ¶ØÖÕµćµÄ·½·ØŹĒ ”£
£Ø3£©×°ÖĆ¢óµÄ×÷ÓĆÖ®Ņ»ŹĒŌŁÉśCe4+£¬ĘäŌĄķČēĻĀĶ¼ĖłŹ¾”£Ķ¼ÖŠAĪŖµēŌ“µÄ £ØĢī”°Õż”±»ņ”°øŗ”±£©¼«”£ÓŅ²ą·“Ó¦ŹŅÖŠ·¢ÉśµÄÖ÷ŅŖµē¼«·“Ó¦Ź½ĪŖ ”£
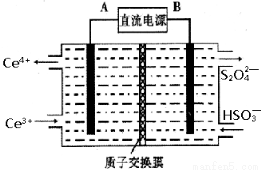
£Ø4£©ŅŃÖŖ½ųČė×°ÖĆ¢ōµÄČÜŅŗÖŠNO2”ŖµÄÅضČĪŖ 0.4 mol/L £¬ŅŖŹ¹ 1m3øĆČÜŅŗÖŠµÄNO2”ŖĶźČ«×Ŗ»ÆĪŖNH4NO3£¬ŠčÖĮÉŁĻņ×°ÖĆ¢ōÖŠĶØČė±ź×¼×“æöĻĀµÄ O2µÄĢå»żĪŖ L”£
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com