
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:________与盐酸反应最剧烈,________与盐酸反应的速度最慢;________与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为___________________。
Ⅱ.利用下图装置可验证同主族元素非金属性的变化规律
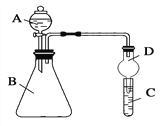
(3)上面装置中D装置的作用是为防止_____________。
(4)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________的现象,即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用________溶液吸收尾气。
【答案】 K Al Al S2-+Cl2═S↓+2Cl- 倒吸 溶液变蓝 NaOH
【解析】Ⅰ、(1)同一周期元素,金属性随着原子序数增大而减弱,元素的金属性越强,其单质与酸或水反应越剧烈,金属性Na>Mg>Al,则Na与盐酸反应最剧烈、Al与盐酸反应速率最慢,1mol钠、镁、铝分别产生的氢气是0.5mol、1mol、1.5mol,即铝产生的氢气最多;(2)氯气具有强氧化性,与硫化钠反应的离子方程式为Cl2+S2-=2Cl-+S↓;
Ⅱ(3)球形干燥管D能够防止倒吸,可以避免C中液体进入锥形瓶中; (2)常温下高锰酸钾能把浓盐酸氧化为氯气,氯气能把碘化钾氧化为单质碘,碘遇淀粉显蓝色,则观察到C中溶液溶液变蓝;氯气是一种有毒气体,必须进行尾气吸收,氯气能够与氢氧化钠溶液反应,可以使用氢氧化钠溶液吸收多余的氯气。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.12C可用于考古断代,推算出文物的年代
B.在一定温度和压强下,气体体积主要取决于气体分子之间的平均间距
C.道尔顿、阿伏伽德罗、卢瑟福、玻尔等科学家的研究不断更新人们对原子结构的认识
D.确定物质中含有哪些金属元素可用原子吸收光谱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对某品牌牙膏中摩擦剂的成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。利用下图所示装置(夹持仪器略去),对该牙膏样品中碳酸钙的含量进行定量测定。
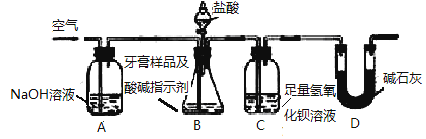
(1)C中反应生成BaCO3的化学方程式是____________________
(2)装置D的作用是______________________
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:___________________
(4)下列各项措施中,不能提高测定准确度的是______(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A→B之间增添盛有浓硫酸的洗气装置
d.在B→C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取10.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。则样品中碳酸钙的质量分数为_________
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会、技术、环境、生活密切相关,下列有关说法中错误的是
A. 石油裂解、煤的干馏和纳米银粒子的聚集都是化学变化
B. 天然气、沼气都是比较清洁的能源,它们的主要成分都是烃类
C. 碘酒、84消毒液、75%的酒精都可用于消毒
D. 高纯硅广泛应用于太阳能电池和计算机芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数,下列叙述正确的是 ( )
A. 1mo1 Na2O2固体中含离子总数为4NA
B. 17gNH3所含的电子数为10NA
C. 1molL1 NaCl溶液中含有Na+的个数为NA
D. 标准状况下,22.4 L的SO3中含有NA个SO3分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向一定量的硫酸铜溶液中滴加pH="11" 的氨水,当Cu2+完全沉淀时,消耗氨水的体积为V,下列说法正确的是(已知Ksp[Cu(OH)2] = 2.2×10-20)( )
A. 若将氨水加水稀释,则稀释过程中,c(NH4+)/c(NH3H2O)始终保持增大
B. 滴加过程中,当溶液中c(Cu2+) = 2.2×10-2 mol/L 时,溶液的pH = 9
C. 滴加过程中,当溶液的pH =" 7" 时,溶液中2c(NH4+)= c(SO42-)
D. 若滴加pH =" 11" 的NaOH 溶液,Cu2+完全沉淀时消耗溶液的体积小于V
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在 -100 ℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键单键双键或三键)所示,下列说法正确的是

A.X能使溴的四氯化碳溶液褪色
B.X是一种在常温下能稳定存在的液态烃
C.X分子中在同一平面上的碳原子最多5个
D.充分燃烧等质量的X和甲烷,X消耗氧气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的熔点均按由高到低的排列,其原因是由于键能由大到小排列的是 ( )
A.铝、钠、干冰
B.金刚石、碳化硅、晶体硅
C.碘化氢、溴化氢、氯化氢
D.二氧化硅、二氧化碳、一氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com