
| 0.9mol |
| 1mol |


科目:高中化学 来源: 题型:
| A、将浓度为0.1mol?L-1 HF溶液加水不断稀释过程中,c( H+) 和c ( OH-)都会减小 |
| B、为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH.若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量KOH溶液,所得溶液呈中性,该溶液中一定含KHSO3 |
| D、用0.200mol?L-1 NaOH标准溶液滴定浓度均为0.1mol?L-1 的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:

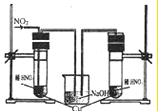
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2、54、24 |
| B、54、2、24 |
| C、32、50、12 |
| D、16、50、24 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、8Al+3Fe3O4
| ||||
B、2Mg+CO2
| ||||
C、N2+3H2
| ||||
D、SiO2+CaO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
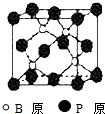 磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.
磷化硼(BP)和氮化硼(BN)是受到高度关注的耐磨涂料,它们的结构相似,图为磷化硼晶体结构中最小的重复结构单元.磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成:BBr3+PBr3+3H2=BP+6HBr.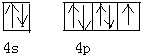 .
.查看答案和解析>>
科目:高中化学 来源: 题型:
 雪花,被人们称为“冬之精灵”,科学研究发现,世界上没有两片雪花的形状完全相同的.下列有关说法正确的是( )
雪花,被人们称为“冬之精灵”,科学研究发现,世界上没有两片雪花的形状完全相同的.下列有关说法正确的是( )| A、在雪花的形成过程中,水分子由运动变为静止 |
| B、雪花融化时,水分子之间的间隔没有发生变化 |
| C、不同雪花中,水分子化学性质不相同 |
| D、不同雪花中,水分子数目都是巨大的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com