
碱性硼化钒(VB2)—空气电池工作时反应为:4VB2 + 11O2 = 4B2O3 + 2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是

A.VB2电极发生的电极反应为:2VB2 + 11H2O - 22e- = V2O5 + 2B2O3 + 22H+
B.外电路中电子由c电极流向VB2电极
C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生
D.若B装置内的液体体积为200 mL,则CuSO4溶液的物质的量浓度为0.05 mol/L
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源:2014-2015广东省高一下学期第一次月考化学试卷(解析版) 题型:选择题
人类应以可持续发展的方式使用资源,以合理的方式对废物进行处理并循环使用,下列做法不利于环境保护的是
A.回收并合理处理废电池 B.将煤转化为水煤气作燃料
C.发电厂的煤经脱硫处理 D.富含重金属离子电镀废液直接排放
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省天水市高二下学期第一次月考化学试卷(解析版) 题型:选择题
按系统命名法命名时,CH3 —CH(C2H5)—CH2—CH(CH3)— CH(CH3) CH(CH3)2的主链碳原子数是
A.5 B.6 C.7 D.8
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市秦安县高三第一次模拟考试化学试卷(解析版) 题型:填空题
【化学—选修3:物质结构与性质】(15分)X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大。X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态。请回答下列问题:
(1)Q+核外电子排布式为_________________________。
(2)化合物X2W2中W的杂化方式为__________,ZW2-离子的立体构型是__________。
(3)Y、R的最高价氧化物的沸点较高的是____________________(填化学式),原因是____________。
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为_______________________________________________________。
(5)Y有多种同素异形体,其中一种同素异形体的晶胞结构如图,该晶体一个晶胞的Y原子数为__________,Y原子的配位数为__________,若晶胞的边长为a pm,晶体的密度为ρ g/cm3,则阿伏加德罗常数的数值为__________(用含a和ρ的代数式表示)。
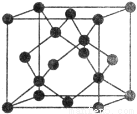
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市秦安县高三第一次模拟考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,T列说法正确的是
A.一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA
B.6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA
C.11 g超重水(T2O)含中子数为5NA
D.常温常压下,11.2 L Cl2含氯原子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省高三第一次诊断考试理综化学试卷(解析版) 题型:填空题
(14分)汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化一还原法消除NOx的转化如下:

①反应I为NO +O3=NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n( NO2):n[CO(NH2)2]=3:2时,氧化产物与还原产物的质量比为______
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+ NOx →N2 +CO2(未配平),若x=1.5,则化学方程式中CO2和N2的化学计量数比为 。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素)。装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式 .


(4)装置Ⅲ的作用之一是用质子交换膜电解槽电解使得Ce4+再生,再生时生成的Ce4+在电解槽的 (填“阳极”或“阴极”),同时在另一极生成S2O42一的电极反应式为 。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为ag.L-1,要使1m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通人标准状况下的氧气 L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省六校联盟高三第三次联考理科综合化学试卷(解析版) 题型:选择题
设nA表示阿伏加德罗常数的数值。下列说法正确的是
A.标准状况下,11.2L CHCl3含有0.5 nA个CHCl3分子
B.常温常压下,16 g O3含有8nA个电子
C.1L 0.1 mol/L醋酸溶液中含有0.1nA个氢离子
D.27g铝片投入足量浓HNO3中生成nA个NO分子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省上饶市高三第二次高考模拟化学试卷(解析版) 题型:实验题
(14分,每空2分)乙醛能与银氨溶液反应析出银。如果条件控制适当,析出的银会均匀地分布在试管壁上,形成光亮的银镜,这个反应又叫银镜反应。银镜的光亮程度与反应条件有关。某课外活动小组同学在课外活动中对乙醛的银镜反应进行了探究。
Ⅰ.探究银镜反应的最佳实验条件的部分实验数据如下表:
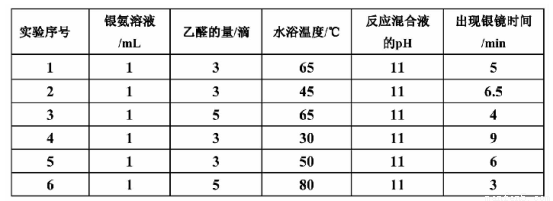
请回答下列问题:
(1)若只进行实验1和实验3,其探究目的是 。
(2)推理当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为40℃,反应混合液pH为11时,出现银镜的时间范围是 。
(3)进一步实验还可探索 对出现银镜快慢的影响。
Ⅱ.探究对废液的回收处理:银氨溶液放久后会变成氮化银而引起爆炸,直接排放会污染环境,且造成银资源的浪费。通过查找资料,已知从银氨溶液中提取银的一种实验流程如下:
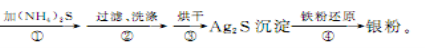
(4)操作④的方法是把Ag2S和铁粉放到烧杯中加浓盐酸搅拌煮沸,使Ag2S变成银粉,反应的化学方程式为 。过滤需要用到的玻璃仪器有 (填编号)。
(5)操作④应在 (填实验室设备名称)中进行。
(6)要洗去试管壁上的银镜,采用的试剂是 (填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com