
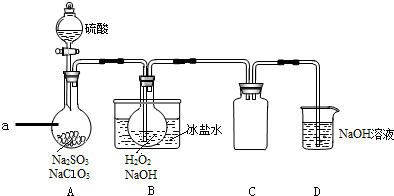
 亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).
亚硝酸钠在漂白、电镀等方面应用广泛.现以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略).分析 (1)根据装置图可知仪器名称;
(2)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置用来吸收二氧化碳和水蒸气;
(3)根据电子得失守恒及元素守恒可写出NO与Na2O2在常温下生成NaNO2的方程式,根据方程式中转移电子数目计算出NO的体积;
(4)D装置是用高锰酸钾氧化未反应的NO气体,根据电荷守恒和元素守恒书写离子方程式;
(5)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO;③2NO+Na2O2→2NaNO2进行计算.
解答 解:(1)根据装置图可知a仪器的名称为分液漏斗,故答案为:分液漏斗;
(2)因为一氧化氮中混有二氧化碳和水蒸汽,二氧化碳和过氧化钠发生的反应生成碳酸钠和氧气,水与过氧化钠反应生成氢氧化钠,为避免产生这些副产物,应在B、C装置间增加装置装碱石灰,用来吸收二氧化碳和水蒸气,
故答案为:碱石灰;
(3)根据电子得失守恒及元素守恒可写出NO与Na2O2在常温下生成NaNO2的方程式为2NO+Na2O2=2NaNO2,该反应中电子转移数目为1e-,根据方程式可知,当反应中转移0.1mole-时,吸收NO的物质的量为0.1mol,则NO的体积为2.24L,
故答案为:2NO+Na2O2=2NaNO2;2.24;
(4)D装置是用高锰酸钾氧化未反应的NO气体,反应的离子方程式为5NO+3MnO4-+4H+=5NO3-+3Mn2++H2O,
故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++H2O;
(5)根据①C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,②3NO2+H2O=2HNO3+NO,有关系式C~4NO2~$\frac{4}{3}$NO~$\frac{8}{3}$HNO3,根据③3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
有关系式HNO3~$\frac{3}{8}$Cu~$\frac{1}{2}$NO,则有C~$\frac{2}{3}$NO,所以碳与总的NO的关系式为C~($\frac{4}{3}$+$\frac{2}{3}$)NO,根据④2NO+Na2O2═2NaNO2,可知碳与Na2O2的关系式为C~Na2O2,所以11.7g过氧化钠完全转化成为亚硝酸钠,理论上至少需要碳的质量为$\frac{11.7}{78}×12$g=1.8g,
故答案为:1.8.
点评 本题考查了物质制备实验方案的设计和信息判断,物质性质的理解应用,注意实验过程中的反应现象分析,掌握基础是关键,(5)中的计算是本题的难点,题目难度中等.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )
如图(Ⅰ)表示反应:mA(g)+nB(g)?pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系.图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变压强,重新建立平衡的反应过程.由此可判断该反应中( )| A. | m+n>p+q,△H<0 | B. | m+n>p+q,△H>0 | C. | m+n<p+q,△H>0 | D. | m+n<p+q,△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com