
| A. | 第2周期元素的第一电离能随原子序数递增依次增大 | |
| B. | 氟元素的电负性最大 | |
| C. | CO2、SO2都是直线形的非极性分子 | |
| D. | CH2═CH2分子中共有四个σ键和一个π键 |
分析 A.Be、N的第一电离能均大于相邻的元素;
B.同主族元素电负性从上到下逐渐减小;
C.SO2含有孤对电子,为V形;
D.单键均为σ键,双键中含1个σ键、1个π键.
解答 解:A.Be的2s电子全满,N原子的2p轨道为半充满状态,较稳定,难以失去电子,第一电离能Be>B、N>O,故A错误;
B.同主族元素电负性从上到下逐渐减小,所遇F元素的电负性最强,故B正确;
C.CO2是直线型的非极性分子,SO2含有孤对电子,为V形,故C错误;
D.CH2=CH2分子中共有四个C-H以及一个C-C键,共五个σ键,一个π键,故D错误.
故选B.
点评 本题考查较为综合,涉及电离能、电负性、分子立体构型以及共价键的分类等知识,题目信息量较大,难度中等,注意相关知识的积累.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
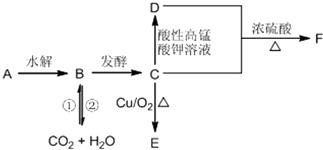
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
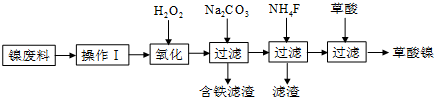
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验验证方法及现象 | |
| 假设1 | 白色浑浊物是BaSO3 | (1)在白色浑浊物中加入过量盐酸,会变澄清 |
假设2 | (2)白色浑浊物是BaSO4,主要 原因是Fe3+氧化了水中的SO2,在Ba2+作用下,生成BaSO4 | 反应开始前,先向制取SO2的装置中通入纯净的CO2,再把产生的SO2通入BaCl2溶液中,不出现浑浊.滴加FeCl3溶液后出现浑浊; (3)通入纯净的CO2的目的防止制备的SO2气体中混有空气(O2)对说明Fe3+氧化SO2造成干扰 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
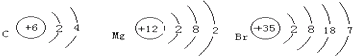
| A. | 第二周期ⅣA族 第二周期ⅢA族 第七周期ⅣA族 | |
| B. | 第四周期ⅡA族 第二周期ⅢA族 第七周期ⅣA族 | |
| C. | 第二周期ⅣA族 第三周期ⅡA族 第四周期ⅦA族 | |
| D. | 第二周期ⅣA族 第三周期ⅡA族 第四周期ⅣA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有离子键的化合物一定是离子化合物 | |
| B. | 非金属元素形成的单质中,一定有非极性共价键 | |
| C. | 两种元素组成的分子中一定只有极性键 | |
| D. | 均由非金属元素形成的化合物不可能是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com