
| A. | ②③④①⑧⑦⑤⑥ | B. | ②③④①⑧⑦⑥⑤ | C. | ②①③④⑧⑦⑥⑤ | D. | ②③④⑧①⑦⑥⑤ |
分析 现用CCl4从碘水中萃取碘并用分液漏斗分离两种溶液,其实验步骤是检漏、加药品、振荡、放置、静置、打开玻璃塞、旋开活塞、倒出液体,以此解答该题.
解答 解:正确操作顺序为:组装铁架台;根据要分离的物质选择适当的溶剂(萃取剂);检查分液漏斗是否漏水,先将要分离的物质的溶液倒入分液漏斗中,然后注入萃取剂;振荡后静置,当液体分成清晰的两层后,打开旋塞,将下层液体放出,然后关闭旋塞,将上层液体从上口倒出,其实验步骤是检漏、加药品、振荡、放置、静置、打开玻璃塞、旋开活塞、倒出液体,所以其操作顺序是②③④①⑧⑦⑥⑤.
故选B.
点评 本题考查物质的分离、提纯的实验方案的设计,为高频考点,侧重考查学生的分析能力和实验能力,注意分液的步骤和萃取剂的选择,选择萃取剂紧扣萃取剂的选择标准判断即可,要注意分液漏斗的使用方法,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
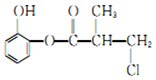
| A. | 有机物A与浓硫酸混合加热,可以发生消去反应 | |
| B. | 1 molA 与足量的H2发生加成反应,最多可以消耗4mol H2 | |
| C. | 1 molA 与足量的NaOH 溶液充分反应,最多可以消耗4 mol NaOH | |
| D. | 有机物A 的同分异构体中能在稀硫酸存在下水解生成二苯酚的有6 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的碳与二氧化碳的反应 | |
| B. | 盐酸与烧碱溶液的反应 | |
| C. | 乙醇在空气中的燃烧 | |
| D. | 氢氧化钡晶体与氯化铵晶体在常温下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ICl+H2O=HCl+HIO | B. | 2K+2H2O=2KOH+H2↑ | ||
| C. | 2F2+2H2O=4HF+O2 | D. | 2Na2O2+2H2O=4NaOH+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
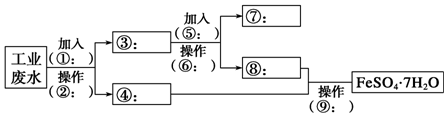
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | D | E | G | I | J | K |
| 化合价 | -1 | -2 | +4 -4 | -1 | +5 -3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
| A. | 常温下B元素的单质能与K单质反应 | |
| B. | A、I、J的离子半径由大到小顺序是A>J>I | |
| C. | G元素的单质存在同素异形体 | |
| D. | J在DB2中燃烧生成B元素的单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4HSO3溶液中,加入过量的氢氧化钠溶液,并加热:NH4++OH- $\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | 向FeBr2溶液中通入过量氯气:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| C. | FeCl3溶液与Cu的反应:Cu+2Fe3+=Cu2++2Fe2+ | |
| D. | 向次氯酸钠溶液中通入少量SO2气体:2ClO-+SO2+H2O=2HClO+SO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com