
| A. | H+、Ba2+、Cl-、NO3- | B. | K+、AlO2-、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Fe3+、NH4+、SCN-、Cl- |
分析 Na2O2具有强氧化性,能和水反应生成氢氧化钠和氧气,加入足量Na2O2后仍能大量共存,说明离子不具有强还原性,且与OH-不反应,
A.氢离子与氢氧根离子反应;
B.四种离子之间不反应,加入过氧化钠后仍然不反应;
C.钙离子、镁离子、碳酸氢根离子都与氢氧根离子反应;
D.铁离子、铵根离子与氢氧根离子反应,铁离子与硫氰根离子发生络合反应.
解答 解:Na2O2具有强氧化性,能和水反应生成氢氧化钠和氧气,加入足量Na2O2后仍能大量共存,说明离子不具有强还原性,且与OH-不反应,
A.H+与氢氧根离子反应,加入过氧化钠后不能大量共存,故A错误;
B.K+、AlO2-、Cl-、SO42-之间不反应,加入过氧化钠后也不反应,在溶液中能够大量共存,故B正确;
C.Ca2+、Mg2+、HCO3-与氢氧根离子反应,加入过氧化钠后不能大量共存,故C错误;
D.Fe3+、NH4+与氢氧根离子反应,Fe3+、SCN-之间发生络合反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的正误判断,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,“加入足量Na2O2后仍能大量共存”说明离子不具有强还原性,且与OH-不反应.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
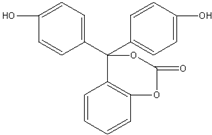 ,下列有关该有机物的说法不正确的是( )
,下列有关该有机物的说法不正确的是( )| A. | 该有机物的化学式为C20H14O5 | |
| B. | 该有机物分子中的三个苯环不可能共平面 | |
| C. | 该有机物可发生加成反应、取代反应、氧化反应 | |
| D. | 1mol该有机物与足量NaOH溶液充分反应,参加反应的NaOH的物质的量为6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.60L | B. | 6.72L | C. | 4.48L | D. | 7.84L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O>NO>N2O5 | B. | NO>N2O>N2O5 | C. | N2O5>NO>N2O | D. | N2O5>N2O>NO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
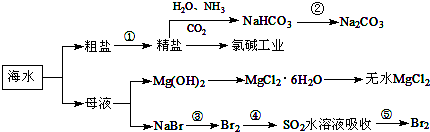
| A. | 要实现反应②可向NaHCO3溶液中加入过量石灰水 | |
| B. | 氯碱工业中采用阴离子交换膜提高产品纯度 | |
| C. | MgCl2溶液加热蒸干可得无水MgCl2 | |
| D. | 溴元素在反应③、⑤中均被氧化,在反应④中被还原 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com