
【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
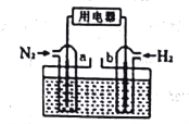
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。
【答案】 CO32-+ H2O![]() HCO3-+OH- c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+) 10-5 = + 1530 kJ·mol-1
HCO3-+OH- c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+) 10-5 = + 1530 kJ·mol-1 ![]() N2 + 6e- + 8H+ = 2NH4+
N2 + 6e- + 8H+ = 2NH4+
【解析】I. (1). 在Na2CO3溶液中,碳酸根离子水解使溶液呈碱性,水解方程式为:CO32-+ H2O![]() HCO3-+OH-,碱性条件下可以促进油污水解,从而达到除油污的目的,故答案为:CO32-+ H2O
HCO3-+OH-,碱性条件下可以促进油污水解,从而达到除油污的目的,故答案为:CO32-+ H2O![]() HCO3-+OH-;
HCO3-+OH-;
(2). 在NaHCO3溶液中,存在的离子有:Na+、H+、OH-、HCO3-、CO32-,电荷守恒式为:c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+),故答案为:c(OH-)+ 2c(CO32-) + c(HCO3-) =c(H+)+ c(Na+);
(3). 25℃时,NH4Cl溶液的pH=5,铵根离子结合水电离出的氢氧根离子生成一水合氨,溶液显酸性,由水电离产生的c(OH)水=c(H+)水=105mol/L,CH3COONH4溶液pH=7,溶液呈中性,说明醋酸根离子和铵根离子水解程度相同,则Ka(CH3COOH)=Kb(NH3H2O),故答案为:105;=;
II. (1). 已知:① N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
② 2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1 ,根据盖斯定律①×2-②×3可得:2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=(-92.4kJ·mol-1 )×2-(-571.6kJ·mol-1)×3= +1530 kJ·mol-1,故答案为:+1530 kJ·mol-1;
4NH3(g) + 3O2(g) △H=(-92.4kJ·mol-1 )×2-(-571.6kJ·mol-1)×3= +1530 kJ·mol-1,故答案为:+1530 kJ·mol-1;
(2). 由反应方程式 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)可知,该反应的平衡常数表达式为K=
Si3N4(s)+ 6CO(g)可知,该反应的平衡常数表达式为K=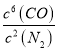 ,故答案为:
,故答案为: 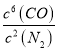 ;
;
(3). 该电池的本质反应是氮气和氢气合成氨的反应,在该原电池中,氢气在负极失电子发生氧化反应,氮气在正极得电子发生还原反应,则a电极反应式为N2 + 6e- + 8H+ = 2NH4+,故答案为:N2 + 6e- + 8H+ = 2NH4+。


科目:高中化学 来源: 题型:
【题目】写出下列对应的化学符号
(1)2个硝酸根离子__________
(2)铁锈的主要成分________ 熟石灰的化学式________
(3)硫原子的结构示意图__________硫化钠中硫元素的化合价________
(4)除去氯化钠溶液中的氢氧化钠和碳酸钠,可加入的试剂是________反应的化学方程式是_______________;________;
(5)实验室制取二氧化碳的化学方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在容积不变的密闭容器中注满NO2气体,2NO2(g)N2O4(g)△H<0.平衡后把该容器置于沸水中,下列性质或数值不会改变的是( )
①颜色 ②平均摩尔质量 ③质量 ④压强 ⑤密度.
A.①② B.②③ C.④⑤ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体和MgCl2溶液共同具备的性质是( )
A.两者均有丁达尔现象
B.两者均能透过半透膜
C.加入盐酸先沉淀,随后溶解
D.分散质微粒可通过滤纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100molL-1的盐酸滴定10ml0.100molL-1的Na2CO3溶液.溶液pH值与加入盐酸的体积的关系如图所示,已知室温时饱和CO2的pH为3.9,0.05molL-1NaHCO3的pH约为8.3,下列说法不正确的是
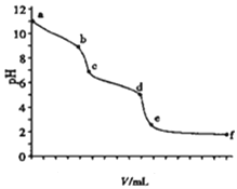
A. 以酚酞为指示剂,溶液颜色发生突变时(b点),Na2CO3转化为NaHCO3
B. 以甲基橙为指示剂,溶液颜色发生突变时,共消耗盐酸20.00ml
C. 溶液pH=7(c点),碳酸钠完全转化为NaCl
D. ce段对应溶液中CO2与NaHCO3共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤炭燃烧过程中会释放出大量的SO2,严重破坏生态环境。采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
CaSO4(s)+CO(g) CaO(s) + SO2(g) + CO2(g) ΔH1=+218.4kJ·mol-1(反应Ⅰ)
CaSO4(s)+4CO(g) CaS(s) + 4CO2(g) ΔH2= -175.6kJ·mol-1(反应Ⅱ)
请回答下列问题:
(1)假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是_____________。

(2)通过监测反应体系中气体浓度的变化可判断反应Ⅰ和Ⅱ是否同时发生,理由是 ______________。

(3)在温度、容积相同且不变的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如图二(已知2SO2(g)+O2(g)=2SO3(g) △H=196.6kJ·mol-1)
A.2c1______c3 B.a+b______196.6 C.2p2______p3 D.α1+α3______1(填>,=,<)
(4) “亚硫酸盐法”吸收烟气中的SO2。室温条件下,将烟气通入氨水溶液中,测得溶液pH与含硫组分物质的量分数的变化关系如图三所示。
请写出a点时n(HSO3-):n(H2SO3)=______,b点时溶液pH=7,则n(NH4+):n(HSO3-)=___。
(5)催化氧化法去除NO,一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO![]() 5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
5N2+ 6H2O。不同温度条件下,n(NH3):n(NO)的物质的量之比分别为4:l、3:l、1:3时,得到NO脱除率曲线如图四所示:
①曲线c对应NH3与NO的物质的量之比是______。
② 曲线a中NO的起始浓度为6×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____mg/(m3·s)。
(6)已知Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=2.5×10-9,向0.4mol/LNa2SO4的溶液中加入足量BaCO3粉末(忽略体积变化),充分搅拌,发生反应SO![]() (aq)+BaCO3 (s) BaSO4 (s)+CO
(aq)+BaCO3 (s) BaSO4 (s)+CO![]() (aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO
(aq) 静置后沉淀转化达到平衡。此时溶液中的c(SO![]() )=________mol·L-1(小数点后两位).
)=________mol·L-1(小数点后两位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用锌粒与盐酸反应制取H2,下列措施不能提高该反应反应速率的是
A.用水将盐酸稀释B.用锌粉代替锌粒
C.适当提高盐酸浓度D.向反应液中滴入少量CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程因发生取代反应而产生的是( )
A.乙烯使溴的四氯化碳溶液褪色
B.将苯加入溴水中,振荡后水层接近无色
C.将苯、浓硫酸、浓硝酸混合后在 50~60 ℃ 水浴中加热
D.乙醇和氧气在铜做催化剂条件下反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向盐酸中加入适量的( )
A.CaCO3(s)B.KNO3溶液
C.Na2SO4溶液D.CuSO4(s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com