
 信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门.分析 (1)根据能量最低原理书写核外电子排布式;
(2)单键为σ键,双键含有1个σ键、个π键;
(3)固态氯化铬酰熔沸点低,易溶于有机溶剂,应属于分子晶体,丙酮中羰基中碳原子形成3个σ键,甲基中碳原子形成4个σ键,均没有孤对电子,杂化轨道数目分别为3、4;二硫化碳与二氧化碳结构相似,为直线型对称结构,分子中正负电荷重心重合;
(4)配离子中Cr3+与C2O42-、H2O之间形成配位键;
(5)利用均摊法计算晶胞中Cr原子数目.
解答 解:(1)Fe(26号元素)原子的基态电子排布式为1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)单键为σ键,双键含有1个σ键、个π键,CH3COCH3分子中含有1个π键,含有9个σ键,
故答案为:1;9;
(3)固态氯化铬酰熔沸点低,易溶于有机溶剂,应属于分子晶体,丙酮中羰基中碳原子形成3个σ键,甲基中碳原子形成4个σ键,均没有孤对电子,杂化轨道数目分别为3、4,甲基碳原子为sp3杂化,羰基碳原子为sp2 杂化,二硫化碳与二氧化碳结构相似,为直线型对称结构,分子中正负电荷重心重合,属于非极性分子,
故答案为:分子;sp3、sp2 ;非极性;
(4)配离子中Cr3+可以空轨道,C2O42-、H2O含有孤对电子,Cr3+与C2O42-、H2O之间形成配位键,
故答案为:配位;
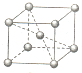
(5)晶胞中Cr原子处于体心与顶点,晶胞中Cr原子数目=1+8×$\frac{1}{8}$=2,
故答案为:2.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、配合物、杂化轨道、晶体类型与性质、分子极性、晶胞计算等,难度不大,注意对基础知识的理解掌握.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
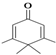 如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )
如图所示的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来命名为Penguinone.下列有关Penguinone的说法不正确的是( )| A. | Penguinone中存在两种官能团 | |
| B. | Penguinone是一种芳香醛 | |
| C. | Penguinone中存在与乙烯相同的官能团,所以其与乙烯有相似的性质 | |
| D. | 如果该分子中的双键都能加成,则1 mol Penguinone能与3 mol氢气反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O、BaSO4、O2 | B. | FeCl2 溶液、Fe 粉、Cl2 | ||
| C. | H2O、CaCO3、SO3气体 | D. | H2O、SiO2、HCl 气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-个数多于CO32-个数 | |
| B. | 逐滴加入稀盐酸,刚开始会产生气体 | |
| C. | c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) | |
| D. | 2c(Na+)=3[c(HCO3-)+c(CO32-)+c(H2CO3)] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
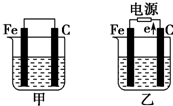 如图所示,甲、乙是电化学实验装置,请回答下列问题:
如图所示,甲、乙是电化学实验装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
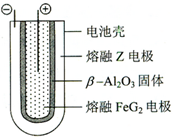 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.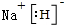 ;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式).
;五种元素中非金属气态氢化物还原性最强的是H2S(写化学式). Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.
Fe+2ZG放电时,电池的正极反应式为Fe2++2e-=Fe:充电时,钠(写物质名称)电极接电源的负极.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有②③⑤ | C. | 全部 | D. | 只有③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com