
分析 (1)根据c=$\frac{1000ρw}{M}$计算该浓硫酸的浓度;令溶液的体积为1000mL,则溶液的质量为18400g,根据$\frac{溶质}{溶液}$=$\frac{溶解度}{100+溶解度}$计算;
(2)根据稀释定律c1V1=c2V2计算需要浓硫酸的体积.
解答 解:(1)质量分数为98%,密度为1.84g/cm3的浓硫酸,其物质的量浓度=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
令溶液的体积为1000mL,则溶液的质量为18400g,由$\frac{溶质}{溶液}$=$\frac{溶解度}{100+溶解度}$可知,$\frac{18.4mol/L×1L×98g/mol}{18400g}$=$\frac{溶解度}{100+溶解度}$,解得:溶解度=10.86g;
故答案为:18.4mol/L;10.86g;
(2)令需要上述浓硫酸的体积为VmL,根据稀释定律,则:18.4 mol/L×VmL=1 mol/L×500mL,解得V=27.2ml;
故答案为:27.2.
点评 本题考查物质的量浓度有关计算,比较基础,侧重对基础知识的巩固,注意对公式的理解与灵活运用,侧重于考查学生的计算能力.


科目:高中化学 来源: 题型:选择题
| A. | X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的酸性强 | |
| B. | X原子的得电子能力比Y原子的得电子能力强 | |
| C. | X的阴离子的还原性比Y的阴离子的还原性强 | |
| D. | X的气态氢化物比Y的气态氢化物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3) | B. | (2)(4) | C. | (1)(2)(4)(6) | D. | (2)(3)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 小明设计的探究燃烧条件的实验如图所示.请回答下列问题.
小明设计的探究燃烧条件的实验如图所示.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
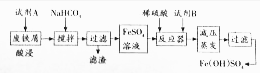
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol KClO3 | B. | 1mol KCl | C. | 1mol Ca(ClO)2 | D. | 2mol NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
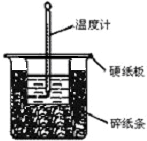 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:| 温度 序号 | 起始温度t1/℃ | 终止温度 T2/℃ | 温度差 △t/℃ | ||
| HCl | NaOH | 平均值 | |||
| 1 | 25 | 25 | 27.3 | ||
| 2 | 25 | 25 | 27.4 | ||
| 3 | 25 | 25 | 28.6 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ②③④ | C. | ③④⑤ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com