
| A. | 二氧化硫、氨、煤的液化均为物理变化 | |
| B. | 2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO | |
| C. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次降低 | |
| D. | 已知常温下氢氧化镁的溶度积常数为a,则氢氧化镁悬浊液中:c(OH-)=$\root{3}{a}$mol/L |
分析 A.煤的液化是化学变化;
B.乙醇的催化氧化机理分析判断,羟基氢和羟基碳上的氢原子去氢氧化;
C.相对分子质量越大,氢键数目越多,则熔沸点越大;
D.氢氧化镁悬浊液中满足:c(OH-)=2c(Mg2+),结合溶度积的表达式计算.
解答 解:A.二氧化硫、氨的液化为物理变化,煤液化是把固体煤炭通过化学加工过程,使其转化成为液体燃料、化工原料和产品的先进洁净煤技术,故A错误;
B.乙醇的催化氧化机理分析判断,羟基氢和羟基碳上的氢原子去氢氧化,重氢在水中,化学方程式为2CH3CH2OD+O2$→_{△}^{Cu}$2CH3CHO+2DHO,故B正确;
C.甲醇、乙二醇、丙三醇相对分子质量逐渐增大,氢键数目增多,则甲醇、乙二醇、丙三醇的沸点依次升高,故C错误;
D.氢氧化镁悬浊液中:c(OH-)=2c(Mg2+),则:c(OH-)=$\root{3}{2a}$mol/L,故D错误;
故选B.
点评 本题考查较为综合,涉及难溶物溶度积的计算、有机物结构与性质、有机反应方程式书写、煤的液化等知识,题目难度中等,注意掌握溶度积常数的表达式,明确常见有机物结构与性质,试题培养了学生的灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
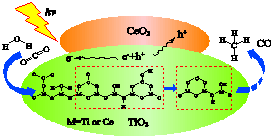 2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )
2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )| A. | 此反应可将光能转化为化学能 | |
| B. | CO2和CH4均含极性共价键 | |
| C. | 产物可能还有O2 | |
| D. | CO2溶于水呈酸性的原因:CO2+H2O?H2CO3H2CO3?2H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与水相比,AgCl在Na2CO3溶液中的溶解度及溶度积均增大 | |
| B. | 反应后的溶液中:c(Na+)>c(CO32-)>c(Cl-)=c(Ag+)>c(OH-)>c(H+) | |
| C. | 溶液中c(Cl-)=2×10-5mol•L-1 | |
| D. | 沉淀转化反应;2AgCl(s)+CO32-(aq)?Ag2CO3(s)+2Cl-(aq)的平衡常数为2×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸在水中电离:CH3COOH?H++CH3COO- | |
| B. | 乙烷和溴蒸气的混合物光照后发生反应:CH3CH3+Br2$\stackrel{光}{→}$CH3CH2Br+HBr | |
| C. | 苯在浓硫酸并加热条件下与浓硝酸发生反应: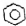 +HNO3$→_{50~60℃}^{浓硫酸}$ +HNO3$→_{50~60℃}^{浓硫酸}$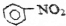 +H2O +H2O | |
| D. | 乙酸、乙醇和浓硫酸的混合物在加热条件下发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 次数 | 1 | 2 | 3 | 4 |
| 滴定体积(mL) | 19.22 | 19.18 | 19.80 | 19.20 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 被氧化的砒霜为1.98mg | B. | 分解产生的氢气为0.672ml | ||
| C. | 转移的电子总数为0.18NA | D. | 和砒霜反应的锌为3.90mg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com