
����FeSO4��Fe2��SO4��3��H2SO4�Ļ����Һ������c��H+��=0.10mol/L��ȡ����Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����27.96g������ȡ�û����Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.00g����ԭ�����Һ��c��Fe2+����c��Fe3+��֮��Ϊ��������
A��4��1 B��3��1 C��2��1 D��1��1
��֪ʶ�㡿�йػ���ﷴӦ�ļ��㣮 C3
���𰸽����� A ����: 200mL�����Һ�������BaCl2��Һ����ַ�Ӧ��õ�����27.96gΪBaSO4�������ʵ���=27.96g/233g·mol=0.12mol�����ݵ���غ��֪2n��SO42-��=2n��Fe2+��+3n��Fe3+��+n��H+������2n��Fe2+��+3n��Fe3+��=0.12mol��2-0.2L��0.1mol/L=0.22mol��
��ȡ�û����Һ200mL�������м������NaOH��Һ��ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������յù���8.00gΪFe2O3�������ʵ���=8g/160g·mol=0.05mol������FeԪ���غ���2n��Fe2O3��=n��Fe2+��+n��Fe3+������n��Fe2+��+n��Fe3+��=0.05mol��2=0.1mol�������ã�n��Fe2+��=0.08mol��n��Fe3+��=0.02mol����Һ�����ȣ�Ũ��֮�ȵ������ʵ���֮�ȣ���ԭ�����Һ��c��Fe2+����c��Fe3+��=0.08mol��0.02mol=4��1��
��˼·�㲦�����⿼���˻����ļ��㣬���������Ӧ�����ǽ���ؼ���ע�������غ�˼����㣬���ؽ��ⷽ��������˼ά�����Ŀ��飬�Ѷ��еȣ�


 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
1��������������ͬϵ�����(����)
A��CH3CH2CH2OH��CH3OH
C��������HCOOCH3
D��CH3CH2Cl��CH3CH2CH2Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���и��Ӧ��Ӧ��ͼ��������
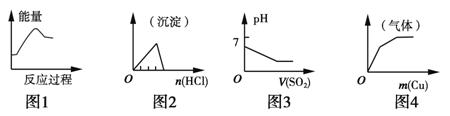
A��ͼ1��������FeCl3��Һ�����ˮ���Ʊ�Fe(OH)3����
B��ͼ2����ϡ������μ���һ����ƫ��������Һ��
C��ͼ3��������������ͨ��һ������ˮ��
D��ͼ4����ͭ������һ����Ũ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Ũ�ȶ�Ϊ0.1 mol/L������Һ�У����루��ͨ��)ij���ʺ�����Ӧ�Ⱥ�˳����ȷ��
A.�ں�Fe3+�� Cu2+�� H+����Һ�м���п�ۣ�Cu 2+�� Fe3+��H+
B.�ں�I-��SO32����Br-����Һ�в���ͨ������:I-��Br-��SO32��
C.�ں�AlO2����SO32����OH������Һ����μ�������������Һ:OH����AlO2����SO3��
D.�ں�Fe 3+�� H+��NH4+ ����Һ�������ռ���Һ:Fe3+��NH4+��H+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����˻������廷�죬�ٶ������廷���е�һ����ʾһ�����ʣ��� 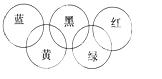
�������ʼ�һ���������ܷ���������Ӧ�������������ʼ䲻�ܷ��� ��Ӧ�������ַ�Ӧ�б���������Ϸ�Ӧ���û���Ӧ�����ֽⷴӦ�� �ʺϵ�һ���ǣ� ��
| �� | �� | �� | �� | �� | |
| A | SiO2 | NaOH��Һ | CuSO4��Һ | Ag | O2 |
| B | O2 | Fe | ϡH2SO4 | NaOH��Һ | CO2 |
| C | O2 | NH3 | ϡH2SO4 | NaOH��Һ | Al(OH)3 |
| D | Mg | Al | CO2 | Fe2O3 | KOH��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��FeCl3��Һ��ʴӡˢ��·���ϵ�ͭ��������Һ�м������ۡ��Լ������۳�ַ�Ӧ�����Һ������������
��A��������ʣ�࣬����Һ��һ����Fe3����B�����й�����ڣ�����Һ��һ����Fe2��
��C������Һ����Cu2������һ��û�й���������D������Һ����Fe2������һ����Cu����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��FeCl3��Һʴ��ͭ�������·��Ĺ����У���Һ��������Դ���յĹ��̼������£�
�����Һ��Ͷ�������м����ַ�Ӧ�������������Һ��
������Һ�м���һ����ʯ��ˮ��������ҺpH��ͬʱ���������Ŀ�����
��֪��Ksp[Fe(OH)3]��4.0��10��38
�ش��������⣺
��1��FeCl3ʴ��ͭ����Ӧ�����ӷ���ʽΪ ��
��2�����̢������м����Ҫ������ ������õ��������Ҫ�ɷ��� ���ӹ����з����ͭ����õķ����� ��
��3�����̢��з�����Ӧ�Ļ�ѧ����ʽΪ ��
��
��4�����̢��е�����Һ��pHΪ5����������Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��ѧ��ѧ��ȤС��Ϊ�˵��鵱��ijһ������ˮ����Ⱦ�������ע�������3 ����ҪˮԴ����ڴ��ɼ�ˮ�����������˷���������������ʵ����Ϣ������һ��ˮԴ����A��B�������ʣ�һ������C��D�������ʣ�һ������E���ʣ�A��B��C��D��EΪ���ֳ�������������±��е������γɣ�
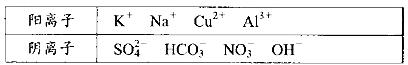
Ϊ�˼���������̨��ֱ��������ʵ�飬�����ǣ�
�ٽ���������ˮ��DΪ��ɫ��Һ��������Ϊ��ɫ��Һ��
�ڽ�E��Һ���뵽C��Һ�г��ְ�ɫ�����������μӣ������ܽ⣻
�۽�����ɫ��Ӧ��ֻ��B��cΪ��ɫ������ɫ�겣������
���ڸ���Һ�м�����������Һ���ټӹ���ϡ���ᣬA�зų���ɫ���壬C��D�ж��ܲ�
����ɫ������
�ݽ�B��D����Һ��ϣ�δ���������������ɡ�
��������ʵ����գ�
(1)д��B��D�Ļ�ѧʽ��B________��D________��
(2)����I mol A����Һ�뺬l molE����Һ��Ӧ�����ڣ����õ�һ�ֻ�̨��û�����Ļ�ѧʽΪ_____________.
(3)��A��Һ�м�����������ʯ��ˮ�������ӷ���ʽΪ________________��
(4)C��������ˮ���������ӷ���ʽ���ʵ�����˵���侻ˮԭ��_____________��
(5)��������lmol��C��Һ����μ���Ba(OH)2��Һ�����ɳ����������Ϊ______________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ҵ�ϴӺ����ķ�Һ����ȡ���ķ���֮һ�ǣ�����������ᴦ�����ϣ������������������ᣬ�������Ṳ�ȣ�����ת��Ϊ������(2HCl+H2SeO4=H2SeO3+Cl2��+H2O)������������Һ��ͨ��SO2���е���������������˵���������
A�������ԣ�H2SeO4>Cl2��H2SeO3>H2SO4 B�����ԣ�H2SO4>H2SeO4> H2SeO3
C������l mol����Ҫ���ı�״����22.4 L SO2
D�������������ϼ��������ԣ����л�ԭ�ԣ�����ԭ�Բ���������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com