


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 |
| B、淀粉、纤维素、蛋白质和油脂都属于高分子化合物,一定条件下都能水解 |
| C、只用水就能鉴别苯、乙醇和四氯化碳 |
| D、分子式C4H8Cl2的有机物,分子中含2个甲基的同分异构体有3种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

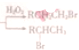 (R:烃基或氧原子,R′:烃基)
(R:烃基或氧原子,R′:烃基)
| OH- |
| -H2O |
 写出以丙烯和
写出以丙烯和 为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2
为原料制备A物质的合成路线图(无机试剂任选),合成路线流程图如下:CH2=CH2| O2 |
| 催化剂 |
| O2 |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
| 原子半径(10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | - |
| 最低价态 | - | - | -2 | - | -4 | -3 | -1 | - | -3 | -1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 预期现象和结论 | |
| ① | 取少量漂白粉于试管中, | |
| ② | ||
| ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com