
| A、在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 |
| B、司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 |
| C、聚酯纤维、碳纤维、光导纤维都属于有机高分子材料 |
| D、石蜡油受热分解产生了可以使酸性高锰酸钾溶液褪色的烯烃 |


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
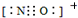
 )、4,4′-联吡啶
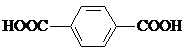
)、4,4′-联吡啶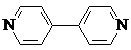 (可简化为
(可简化为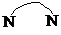 )等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如图2:
)等与Ni2+能形成多核配合物.配合物[Ni2(TPHA)(bpy)4](ClO4)2络离子的结构如图2: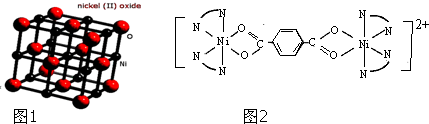
查看答案和解析>>
科目:高中化学 来源: 题型:
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某吸热反应能自发进行,则该反应的△S>0 |
| B、SO2使酸性KMnO4溶液褪色,因此SO2具有漂白性 |
| C、在物质分离的方法中,蒸馏、萃取、重结晶都与物质的溶解度有关 |
| D、用浓硫酸代替稀硫酸与铁反应能加快生成H2的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4 L H2和O2的混合气体中所含的分子数为NA |
| B、6.8g熔融的KHSO4中含有0.05NA个阳离子 |
| C、21.6 g X单质与Cl2完全反应,生成106.8 g XC13.,则X的相对原子质量为27g/mol |
| D、0.1molNa2O2晶体中含有0.1NA个阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
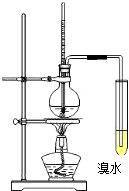 实验室以浓硫酸和酒精为原料制取乙烯并进行乙烯性质实验的装置如图所示.
实验室以浓硫酸和酒精为原料制取乙烯并进行乙烯性质实验的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.1gCl2与5.6gFe反应,转移的电子总数为0.3NA |
| B、实验室中用含4molHCl的浓盐酸跟足量MnO2加热反应可制得Cl2的分子数为NA |
| C、1 mol OH-和1 mol-OH (羟基)中含有的质子数均为9NA |
| D、标准状况下,22.4mLH2O约含有 3.73NA个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
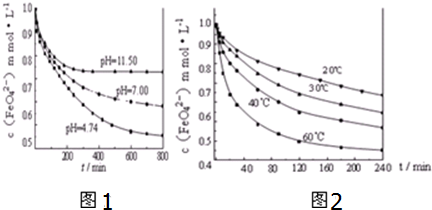
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com