
| 5.13g |
| 171g/mol |
| 5.13g |
| 171g/mol |
| 5.13g |
| 171g/mol |


科目:高中化学 来源: 题型:
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 石灰水 | 硫酸钡 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 冰醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
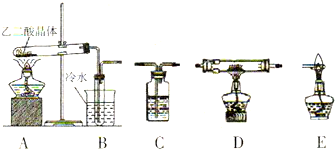
| 装置编号 | 装置中所加物质 | 装置作用 |
| B | -------- | |
| C | ||
| C | 氢氧化钠浓溶液 | |
| C | ||
| D | ||
| E | -------- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加入试剂 | 0.1mol/LH2C2O4溶液 | 0.2mol/LH2C2O4溶液 |
| 实验现象 | ||
| 褪色时间 | 16s | 9s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、CO32- |
| B、在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C、在NH4+的溶液中:SiO32-、K+、SO42-、NO3- |
| D、在HCO3-的溶液中:K+、Na+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
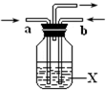 A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:
A、B、C、D、E、F、G、H是相对分子质量依次增大的气体,它们均由短周期元素组成,具有如下性质:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25% | B、<25% |
| C、>25% | D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2a=c-d-2b |
| B、a=c-d-2b |
| C、2a=c+d-2b |
| D、a=c+d-b/2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com