
分析 碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为4H2O+2O2+8e-═8OH-,其总反应为CH4+2OH-+2O2=CO32-+3H2O,根据电极反应进行计算,以此解答该题.
解答 解:碱性甲烷燃料电池,具有还原性的甲烷为原电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,通入氧气的一极为原电池的正极,发生还原反应,电极反应式为4H2O+2O2+8e-═8OH-,其总反应为CH4+2OH-+2O2=CO32-+3H2O,
故答案为:CH4+2OH-+2O2=CO32-+3H2O;
(1)根据上述分析,通入甲烷的负极反应为CH4+10OH--8e-=CO32-+7H2O,
故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)根据负极反应CH4+10OH--8e-=CO32-+7H2O,当通入5.6L甲烷气体即$\frac{5.6L}{22.4L/mol}$=0.25mol,所以完全反应后有0.25mol×8=2mol电子转移,
故答案为:2.
点评 本题考查了燃料电池,为高频考点,明确得失电子与正负极的关系是解本题关键,能正确书写电池反应式并据此进行计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 信息 | 问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大,最外层电子数均不少于最内层电子数 | (1)X一定不是AD A.氢 B.碳 C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH溶液,氧化物的相对分子质量都大于26 | (2)这四种元素中有铝元素吗?可能 |
| ③向上述四种元素的单质的混合物中,加入足量的盐酸,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中有白色沉淀 | (3)白色沉淀的化学式为Mg(OH)2 |
| ④向上述四种元素的单质的混合物中,加入足量的烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸,最终溶液中有白色沉淀 | (4)生成白色沉淀的离子方程式为SiO32-+2H+=H2SiO3↓(或SiO32-+2H++H2O=H4SiO4↓) |
| ⑤X与W同主族 | (5)X的最高价氧化物的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
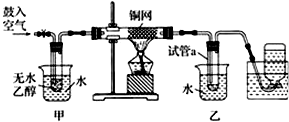
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>D>B | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
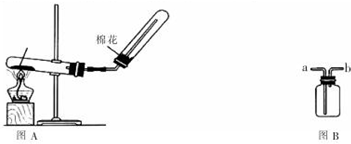
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com