
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2 Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体,溶液变浑浊CO32-+CO2+H2O=HCO3- |
分析 A.二者反应生成硫酸钠和氢气;
B.二者反应生成氢氧化钠和氧气;
C.碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀反应生成碳酸钙、碳酸氢钠和水;
D.碳酸氢钠的溶解度小于碳酸钠的溶解度.
解答 解:A.Na与稀硫酸反应的离子方程式为:2Na+2H+═2 Na++H2↑,故A正确;
B.Na2O2溶于水产生O2离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,故B正确;
C.碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀,离子方程式:Ca2++HCO3-+OH-=CaCO3↓+H2O,故C正确;
D.向饱和碳酸钠溶液中通入足量二氧化碳气体,离子方程式:2Na++CO32-+H2O+CO2=2NaHCO3↓,故D错误;
故选:D.
点评 本题考查了离子方程式的书写,题目难度不大,解题时应注意化学式的拆分、反应物用量对反应的影响.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题

| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与0.8 molNaOH反应 | |
| C. | 能发生取代反应和消去反应 | |
| D. | 能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
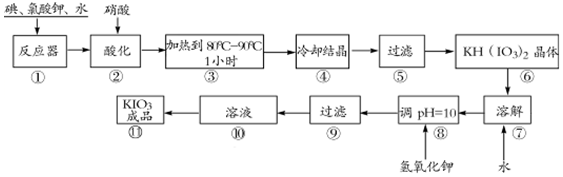
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是还原剂 | |
| B. | 维生素C的还原性强于Fe2+ | |
| C. | 1×10-3molFe2+被NaNO2氧化为Fe3+时得到1×10-3mol电子 | |
| D. | 解毒过程中维生素C被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可以提高NO和CO的转化率 | |
| B. | 使用高效催化剂可以提高NO和CO的转化率 | |
| C. | 反应达到平衡后,NO 的生成速率和消耗速率相等 | |
| D. | 若该反应已达到平衡状态,增大压强(通过减小体积实现)对平衡无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 角鲨烯分子式为C30H50 | |
| B. | 角鲨烯可以被酸性KMnO4溶液所氧化 | |
| C. | 1mol角鲨烯最多可与6molH2发生加成反应 | |
| D. | 汽油经过催化裂化可以获得角鲨烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质硅可用作光导纤维 | |
| B. | 普通玻璃、陶瓷、水泥属于传统无机非金属材料 | |
| C. | 石英晶体是一种空间立体网状结构的晶体,熔点高,硬度大 | |
| D. | 水玻璃可用于制备硅胶和木材防火剂的原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度 | B. | 分离出CO(NH2)2 | C. | 缩小容器体积 | D. | 使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com