
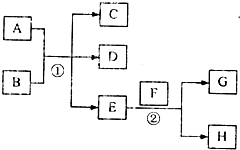
 ��֪������EΪ��ɫ��ζ��Һ�壬FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ�
��֪������EΪ��ɫ��ζ��Һ�壬FΪ����ɫ��ĩ��GΪ��������ɫ���壨��Ӧ��������ʡ�ԣ�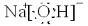 ����Ӧ���ǹ������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����
����Ӧ���ǹ������ƺ�ˮ��Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Na2O2+2H2O=4NaOH+O2����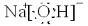 ��2Na2O2+2H2O=4NaOH+O2����
��2Na2O2+2H2O=4NaOH+O2����
| ||
| ||


 ��ս100��Ԫ����Ծ�ϵ�д�
��ս100��Ԫ����Ծ�ϵ�д� ������ϵ�д�
������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.43g |
| B��0.87g |
| C��13.1g |
| D��16.2g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ������Fe�뺬1mol HNO3��ϡ����ǡ�÷�Ӧ����ԭ�ĵ�ԭ����С��NA |
| B��1L 0.5mol/L Na2CO3��Һ�к��е�CO32-��ĿΪ0.5NA |
| C����״���£�2.24L Cl2��������Mg��ַ�Ӧ��ת�Ƶĵ�����ĿΪ0.2NA |
| D��0.1mol CH4�����ĵ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
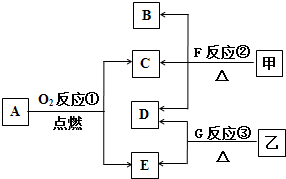 ����A��G���ס�������ͼת����ϵ��
����A��G���ס�������ͼת����ϵ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com