
科目:高中化学 来源: 题型:
下列物质的沸点逐渐升高的是
A. NH3 PH3 AsH3 SbH3 B. CH4 SiH4 GeH4 SnH4
C. CI4 CBr4 CF4 CCl4 D. HF HCl HBr HI
查看答案和解析>>
科目:高中化学 来源: 题型:
已知尿素的结构式为: 尿素可用于制有机铁肥,主要
代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
(1)C、N、O三种元素的第一电离能由大到小的顺序是 ;电负性由大到小顺序是 。
(2)尿素分子中C和N原子的杂化方式分别是 、 。
(3)NH4+中H—N—H键角比NH3中H—N—H键角大,原因为 。
(4)美国科学家合成了结构呈“V”形的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是 。
A.每个N5+中含有35个质子和36个电子 B.该离子中有非极性键和配位键
C.该离子中含有2个π键 D.与PCl4+互为等电子体
(5)[Fe(H2NCONH2)6](NO3)3中H2NCONH2与Fe(Ⅲ)之间的作用力是 。
FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是 。
KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
物质的量之比为2∶5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是( )
A.1∶4 B.1∶5
C.2∶3 D.2∶5
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温时可以与木炭反应
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

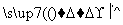

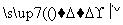

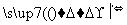

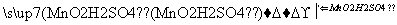

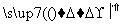

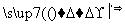

请填写下列空白:
(1)步骤⑤所用的主要仪器是________。
(2)步骤③的实验操作名称是______________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是____________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是____________________ ___________________________________________________________________________。
(5)①~⑥操作中,使用玻璃棒的是________(填序号)。
(6)请设计一种检验提取碘后的水溶液中是否还有单质碘的简单方法:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
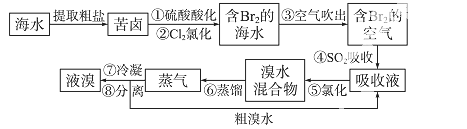
(1)溴在周期表中位于第 _周期第 _族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是 _。
(3)步骤④利用了SO2的还原性,反应的离子方程式为 _。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因 _。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是 _。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是 _。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com